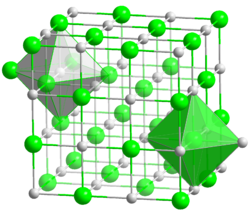
Natrium
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
Natrium ist ein chemisches Element mit dem Symbol Na und der Ordnungszahl 11. Im Periodensystem der Elemente steht es in der 3. Periode und als Alkalimetall in der 1. IUPAC-Gruppe bzw. 1. Hauptgruppe. Natrium ist ein Reinelement, dessen einziges stabiles Isotop 23Na ist.
Elementares Natrium wurde erstmals 1807 von Humphry Davy durch Schmelzflusselektrolyse aus Natriumhydroxid gewonnen und Sodium genannt. Diese Bezeichnung ist im englischen und im französischen Sprachraum und, mit leichten Abwandlungen (etwa Sodio), in anderen romanischen sowie manchen slawischen Sprachen gebräuchlich. Im Deutschen, im Niederländischen und in skandinavischen Sprachen wird die Bezeichnung Natrium verwendet, Ableitungen hiervon finden sich auch in einigen slawischen und weiteren Sprachen, wie japanisch ナトリウム Natoriumu. Der Name Natrium geht über arabisch نطرون, DMG naṭrūn ‚Natron‘ auf ägyptisch netjerj zurück.
Unter Normalbedingungen ist Natrium ein wachsweiches, silberglänzendes und hochreaktives Metall. Wegen seiner starken Reaktivität wird metallisches (elementares) Natrium unter inerten Bedingungen gelagert, meistens in Paraffinöl oder Petroleum, bei größeren Mengen in luftdicht verschlossenen Stahlfässern.
In der Erdhülle gehört Natrium zu den zehn häufigsten Elementen und kommt in zahlreichen Mineralen der Erdkruste vor. In Meerwasser ist eine erhebliche Menge Natrium in Form von Natriumionen enthalten.
| Eigenschaften | |
|---|---|
| Allgemein | |
| Name, Symbol, Ordnungszahl | Natrium, Na, 11 |
| Elementkategorie | Alkalimetalle |
| Gruppe, Periode, Block | 1, 3, s |
| Aussehen | silbrig weiß |
| CAS-Nummer | |
| EG-Nummer | 231-132-9 |
| ECHA-InfoCard | |
| Massenanteil an der Erdhülle | 2,64 % (6. Rang)[1] |
| Physikalisch[2] | |
| Aggregatzustand | fest |
| Kristallstruktur | kubisch raumzentriert |
| Dichte | 0,968 g/cm3 (20 °C)[7] |
| Mohshärte | 0,5 |
| Magnetismus | paramagnetisch (Χm = 8,5 · 10−6)[8] |
| Schmelzpunkt | 370,87 K (97,72 °C) |
| Siedepunkt | 1163 K[9] (890 °C) |
| Molares Volumen | 23,78 · 10−6 m3·mol−1 |
| Verdampfungsenthalpie | 97,4 kJ/mol[49]4 |
| Schmelzenthalpie | 2,6[10] kJ·mol−1 |
| Dampfdruck | 1 Pa bei 554[12] K |
| Schallgeschwindigkeit | 3200 m·s−1 bei 293,15 K |
| Spezifische Wärmekapazität | 1230 J·kg−1·K−1 |
| Austrittsarbeit | 2,75 eV[11] |
| Elektrische Leitfähigkeit | 21 · 106 S·m−1 |
| Wärmeleitfähigkeit | 140 W·m−1·K−1 |
| Chemisch[2] | |
| Oxidationszustände | 1 |
| Normalpotential | −2,713 V (Na+ + e− → Na) |
| Elektronegativität | 0,93 (Pauling-Skala) |
Geschichte

Natrium her
Die Herstellung von elementarem Natrium gelang erst im Jahre 1807 Humphry Davy durch Elektrolyse von geschmolzenem Natriumhydroxid (Ätznatron) unter Verwendung von Voltaschen Säulen als Stromquelle. Wie er am 19. November 1807 vor der Royal Society in London berichtete, gewann er zwei verschiedene Metalle: Das in Soda enthaltene Natrium nannte er Sodium, was die noch gebräuchliche Bezeichnung des Metalls im französischen und englischsprachigen Raum ist; das andere Metall nannte er Potassium (Kalium). Den Namen Natrium schlug 1811 Jöns Jakob Berzelius vor.[15]
Natriumverbindungen sind im Gegensatz zum elementaren Metall schon sehr lange bekannt. Schon früh wurden die aus Meerwasser, Salzseen oder Erdlagerstätten gewonnenen Produkte teils bis in ferne Regionen gehandelt. Sie enthielten überwiegend das Natriumchlorid (Kochsalz) als die wichtigste Natriumverbindung in fester Form. Deren wässrige Lösung wird vornehmlich für Speisesalz bei der Salzgewinnung zunächst im Einengen zunehmend konzentriert (Gradierwerke) und das Lösungsmittel schließlich verdampft (Salinen) – durch Verdunsten von Meerwasser oder durch Eindampfen von Sole salzhaltiger Quellen oder aus Salzbergwerken. Der Handel mit Salz machte manche Städte reich und prägte ihren Namen, so Salzgitter und Salzburg. Bei anderen weist Hall im Ortsnamen auf die Salzgewinnung[16] hin (z. B. Hallstatt, Hallein, Niedernhall, Bad Hall, Bad Reichenhall, Schwäbisch Hall, Hall in Tirol. Halle und Schweizerhalle). Daneben wurden auch andere natürlich vorkommende Natriumverbindungen wie Natriumcarbonat (Soda) und Natriumhydrogencarbonat (Natron) sowie Natriumnitrat (Natronsalpeter) schon in der Antike gewonnen und gehandelt. Die Ägypter bezeichneten das aus Natronseen gewonnene Soda bzw. Natron als netjerj (ntr). Die Griechen entlehnten dieses Wort als νίτρον nitron, die Römer als nitrium, die Araber als natrun.[15]
Vorkommen
Im Universum steht Natrium in der Häufigkeit an 14. Stelle,[17] vergleichbar mit Calcium und Nickel. Im ausgestrahlten Licht vieler Himmelskörper, auch dem der Sonne, kann die gelbe Natrium-D-Linie gut nachgewiesen werden.
Auf der Erde ist Natrium mit einem Anteil an der Erdkruste von 2,36 %[18] das sechsthäufigste Element. Es kommt aufgrund seiner Reaktivität nicht elementar, sondern stets in Verbindungen, den Natrium-Salzen, vor. Ein großer Speicher von Natrium ist das Meerwasser. Ein Liter Meerwasser enthält durchschnittlich 11 Gramm Natriumionen.[19]

Häufige Natriumminerale sind Albit (Natronfeldspat genannt), NaAlSi3O8 und Oligoklas (Na,Ca)Al(Si,Al)3O8. Neben diesen gesteinsbildenden Mineralen, die zu den Feldspaten zählen, kommt Natrium in großen Salzlagerstätten vor. Es existieren vor allem große Lagerstätten an Halit (Natriumchlorid, umgangssprachlich häufig Steinsalz genannt), die durch das Austrocknen von Meeresteilen entstanden sind. Diese stellen die wichtigste Quelle zur Gewinnung von Natrium und seinen Verbindungen dar. Bekannte deutsche Salzförderstätten sind unter anderem Salzgitter, Bad Reichenhall, Stade und Bad Friedrichshall.
Neben dem häufigen Natriumchlorid kommen in der Natur weitere Verbindungen vor. So ist Natriumnitrat oder Natronsalpeter (auch Chilesalpeter genannt) NaNO3 eines der wenigen natürlichen Nitratminerale. Es kommt wegen seiner guten Wasserlöslichkeit aber nur in besonders trockenen Gegenden, wie der Atacamawüste in Chile vor. Vor Erfindung des Haber-Bosch-Verfahrens war dies der wichtigste Rohstoff für viele Düngemittel und Sprengstoffe.
Natriumcarbonat Na2CO3 wird ebenfalls natürlich in mehreren Mineralen gefunden. Das bekannteste Mineral ist Soda Na2CO3 · 10 H2O. Es wird in großen Mengen abgebaut und vor allem in der Glasherstellung verwendet.
Daneben existieren noch eine Vielzahl weiterer Natriumminerale. Ein bekanntes ist der Kryolith (Eisstein, Na3[AlF6]), der in geschmolzenem Zustand als Lösungsmittel für Aluminiumoxid bei der Aluminiumherstellung dient. Da das einzige bekannte Kryolith-Vorkommen in Grönland abgebaut ist, wird Kryolith künstlich hergestellt.
Gewinnung und Darstellung

Natrium wird hauptsächlich aus Natriumchlorid gewonnen, welches meist bergmännisch oder durch Austrocknung salzhaltiger Lösungen wie dem Meerwasser erhalten wird. Nur ein kleiner Teil des Natriumchlorids wird zu elementarem Natrium weiterverarbeitet, der größte Teil wird als Speisesalz oder für die Herstellung anderer Natriumverbindungen verwendet.
Die großtechnische Herstellung von Natrium erfolgt durch Schmelzflusselektrolyse von trockenem Natriumchlorid in einer sogenannten Downs-Zelle (1924 patentiert von James C. Downs).[20] Zur Schmelzpunkterniedrigung wird ein eutektisches Salzgemisch aus 60 % Calciumchlorid und 40 % Natriumchlorid eingesetzt, das bei 580 °C schmilzt. Auch Bariumchlorid ist als Zusatz möglich. Es wird eine Spannung von etwa sieben Volt angelegt.[19] Für die Herstellung von einem Kilogramm Natrium werden während der Elektrolyse etwa 10 kWh (36 Megajoule) Strom verbraucht, im gesamten Produktionsprozess etwa 12 kWh.[21]
- Bildung von Natrium an der Kathode
- Bildung von Chlor an der Anode
- Gesamtreaktion
Die zylindrische Elektrolysezelle besteht aus einer mittigen Graphitanode und einem seitlichen Kathodenring aus Eisen. Oberhalb der Zelle ist eine Glocke, die das entstandene Chlor sammelt und abführt. Das Natrium sammelt sich oberhalb der Kathoden und wird durch ein gekühltes Steigrohr aus der Zelle entfernt. Ebenfalls entstandenes Calcium kristallisiert dort aus und fällt in die Schmelze zurück.
Die Elektrolyse von Natriumchlorid löste das Castner-Verfahren ab. Dabei wurde das Natrium durch Schmelzflusselektrolyse von Natriumhydroxid gewonnen. Dieses hatte zwar den Vorteil des geringeren Schmelzpunktes von Natriumhydroxid (318 °C), es wird aber mehr elektrische Energie benötigt. Seit Einführung der Chlor-Alkali-Schmelzflusselektrolyse hat sich der Preis für Natrium drastisch verringert. Der Preis hängt allerdings stark von den Stromkosten und dem Preis für das ebenfalls entstehende Chlor ab.
Eigenschaften
Physikalische Eigenschaften

.jpg)
Natrium ist ein silberweißes, weiches Leichtmetall. In vielen Eigenschaften steht es zwischen Lithium und Kalium. So liegt der Schmelzpunkt mit 97,82 °C zwischen dem des Lithiums (180,54 °C) und dem des Kaliums (63,6 °C).[19] Ähnlich ist dies beim Siedepunkt und der spezifischen Wärmekapazität. Mit einer Dichte von 0,968 g / cm3[19] ist Natrium eines der spezifisch leichtesten Elemente. Von den bei Raumtemperatur festen Elementen haben nur noch Lithium und Kalium eine geringere Dichte. Mit einer Mohshärte von 0,5[23] ist Natrium so weich, dass es mit dem Messer zu schneiden ist.
Natrium kristallisiert, wie die anderen Alkalimetalle, im kubischen Kristallsystem in einem raumzentrierten Gitter mit der Raumgruppe Im3m (Raumgruppen-Nr. 229) und zwei Formeleinheiten pro Elementarzelle. Unterhalb von 51 K geht es in eine hexagonal dichteste Kugelpackung mit den Gitterparametern a = 376 pm und c = 615 pm über.[22]
Natriumdampf besteht sowohl aus einzelnen Metallatomen als auch aus Dimeren der Form Na2. Am Siedepunkt liegen 16 %[19] der Atome als Dimer vor. Der Dampf ist gelb und erscheint in der Durchsicht purpurfarben.
Mit Kalium werden in einem weiten Konzentrationsbereich bei Raumtemperatur flüssige Gemische gebildet. Das Phasendiagramm zeigt eine bei 7 °C inkongruent schmelzende Verbindung Na2K und ein Eutektikum bei −12,6 °C mit einem Kaliumgehalt von 77 % (Massenanteil).[24]
Chemische Eigenschaften
Wie die anderen Alkalimetalle ist Natrium ein sehr unedles Element (Normalpotential: −2,71 V[19]) und reagiert leicht mit vielen anderen Elementen und zum Teil mit Verbindungen. Die Reaktionen sind vor allem mit Nichtmetallen, wie Chlor oder Schwefel, sehr heftig und laufen unter leuchtend gelber Flammenerscheinung ab.
Der ansonsten reaktive Sauerstoff stellt eine Besonderheit dar. Natrium und Sauerstoff reagieren ohne Anwesenheit von Wasser bei Raumtemperatur oder beim Erwärmen nicht direkt miteinander. Unter einer vollkommen wasserfreien Sauerstoff-Atmosphäre kann Natrium sogar geschmolzen werden, ohne dass es zur Reaktion kommt. Sind dagegen Feuchtigkeitsspuren vorhanden, verbrennt es leicht zu Natriumperoxid.[19]
- Reaktion von Natrium mit Sauerstoff

Mit Wasser reagiert Natrium unter Bildung von Wasserstoff zu Natriumhydroxid. Hochgeschwindigkeitsaufnahmen der Reaktion von Alkalimetallen mit Wasser legen eine Coulomb-Explosion nahe.[25]
- Reaktion von Natrium mit Wasser
In Alkoholen setzt sich Natrium unter Bildung von Wasserstoff zu Natrium-Alkoholaten um. Durch die hohe Reaktionswärme schmilzt es häufig auf. Bei feiner Verteilung des Natriums und der damit einhergehenden großen Reaktionsoberfläche kann die Reaktion explosiv sein und den Wasserstoff entzünden.
- Reaktion von Natrium mit Ethanol
Kommt Natrium mit chlorierten Verbindungen wie Dichlormethan, Chloroform, Tetrachlormethan in Kontakt, kommt es unter Bildung von Natriumchlorid zu einer schnellen und exothermen Reaktion.

Natrium löst sich mit blauer Färbung in flüssigem Ammoniak. Die Farbe beruht auf freien Elektronen, die vom Natrium in die Lösung abgegeben werden. So leitet die Lösung auch elektrischen Strom und ist verdünnt paramagnetisch. Auf ähnliche Art und Weise lässt sich auch das Anion des Natriums, das Natrid-Ion, zum Beispiel in der Form des Kalium(2.2.2-Kryptand)natrids (K+(C222)Na−) darstellen.[26] Es ist ein sehr starkes Reduktionsmittel.
Isotope
Von Natrium sind insgesamt 20 Isotope und 3 weitere Kernisomere von 18Na bis 37Na bekannt.[27] Von diesen kommt nur eines, das Isotop 23Na natürlich vor. Damit ist Natrium eines von 22 Reinelementen. Die langlebigsten künstlichen Isotope sind 22Na, das mit einer Halbwertszeit von 2,602 Jahren[27] unter Beta-Plus-Zerfall (β+) in 22Ne übergeht und 24Na, das mit einer Halbwertszeit von 14,957 Stunden[27] ebenfalls unter Betazerfall zu 24Mg zerfällt. Diese werden als Tracer in der Nuklearmedizin verwendet. 22Na lässt sich durch mehrwöchige Bestrahlung von Magnesium-[28] oder Aluminium-Targets[29] mit Protonen aus einem Zyklotron herstellen. 24Na entsteht durch Neutroneneinfang aus 23Na und kann in Forschungsreaktoren hergestellt werden. Das Isotop 39Na wurde 2018 in Japan entdeckt.[30] Analog zur Kobaltbombe wurde verschiedentlich eine „gesalzene Atombombe“ (salted bomb) mit Natrium (z. B. in Form von Kochsalz) im Mantel diskutiert, um den Fallout besonders radioaktiv zu machen.[31] Nach allen öffentlich bekannten Informationen wurde eine solche Waffe weder jemals gebaut, noch getestet. 24Na entsteht auch bei Detonationen von Atombomben in Meerwasser, da das enthaltene Salz intensiver Neutronenstrahlung ausgesetzt ist.
Alle anderen Isotope und Isomere haben nur kurze Halbwertszeiten von Sekunden oder Millisekunden.
Verwendung
Es werden große Mengen Natriumchlorid und andere Natriumverbindungen, wie Natriumcarbonat, gefördert. Davon wird aber nur ein sehr kleiner Teil zu Natrium weiterverarbeitet. Der größte Teil wird direkt verwendet oder zu anderen Verbindungen umgesetzt. Über Verwendungsmöglichkeiten von Natriumverbindungen: siehe Abschnitt Verbindungen.
Natrium ist das meistgebrauchte Alkalimetall. Es wird für diverse Zwecke sowohl technisch als auch im Labor eingesetzt. Im Schulunterricht und bei Experimentalvorlesungen kann Natrium mit Hilfe eines Natriumlöffels und Wasser zur Wasserstoffherstellung verwendet werden.[32] Aus einem Teil des Natriums wird eine Anzahl von Natriumverbindungen hergestellt. Dies sind beispielsweise das als Bleichmittel verwendete Natriumperoxid und die starke Base Natriumamid. Diese kommen nicht natürlich vor und können auch nicht direkt aus Natriumchlorid gewonnen werden. Natriumcyanid und Natriumhydrid werden aus Natrium hergestellt. Da Natrium das Erstarrungsgefüge beeinflusst, kann es als Zusatz von Aluminium-Silicium-Legierungen verwendet werden (Veredelungsverfahren nach Aladár Pácz).
Katalysator
Natrium katalysiert die Polymerisation von 1,3-Butadien und Isopren. Daher wurde es für die Produktion von künstlichen Kautschuk eingesetzt.[33] Mit Natrium als Katalysator gewonnener Kunststoff, der als Buna bezeichnet wurde, war das erste künstliche Gummi der Welt. Ab 1937 wurde er in den Buna-Werken (benannt nach Butadien und Natrium) in Schkopau produziert.[34]
Kühlmittel
Da Natrium mit einer Wärmeleitfähigkeit von 140 W/(m·K), die weit über der von Stahl (15 bis 58 W/(m·K)) liegt, gute Wärmeübertragungseigenschaften und ebenso einen niedrigen Schmelzpunkt mit gleichzeitig großem flüssigen Bereich besitzt, wird es als Kühlmittel zur Kühlung der thermisch hoch beanspruchten Auslassventile in Verbrennungsmotoren verwendet. Hierzu werden die Ventilschäfte hohl ausgeführt und zum Teil mit Natrium gefüllt. Im Betrieb schmilzt das Natrium und schwappt zwischen der heißen und kalten Seite hin und her. Die Wärme wird dadurch vom rotglühend heißen Ventilteller abtransportiert.
Schnelle Brüter werden mit geschmolzenem Natrium gekühlt. In solchen Brutreaktoren dürfen die bei der Kernspaltung entstehenden schnellen Neutronen nicht wie in anderen Reaktortypen zwischen den Brennstäben abgebremst werden. Es darf daher zur Kühlung kein Wasser, das als Bremsmittel (Moderator) wirkt, eingesetzt werden. Die Wärme wird dann über einen Sekundärnatriumkreislauf an den Dampferzeuger für den Turbinenbetrieb weitergegeben.[35]
Lichterzeugung

Natriumdampflampen nutzen das charakteristische gelbe Licht aus, das Natriumdampf bei einer elektrischen Entladung aussendet. Sie werden aufgrund ihrer hohen Lichtausbeute häufig zur Straßenbeleuchtung eingesetzt.
Reduktionsmittel
Einige Metalle, wie Titan, Zirconium, Tantal oder Uran können nicht durch Reduktion mit Kohlenstoff gewonnen werden, weil dabei stabile und nicht abtrennbare Carbide entstehen. Neben einigen anderen Elementen, insbesondere Aluminium und Magnesium, wird daher Natrium als Reduktionsmittel eingesetzt. Ein weiteres Element, zu dessen Darstellung Natrium eingesetzt wird, ist Kalium. Da Kalium ein sehr unedles Element ist, kann es nicht durch Reduktion mit Kohlenstoff gewonnen werden. Eine theoretisch mögliche Herstellung durch Elektrolyse ist technisch auf Grund der guten Löslichkeit von Kalium in einer Kaliumchloridschmelze nicht möglich.
Natrium spielt eine wichtige Rolle als Reduktionsmittel in der organischen Synthese. Über lange Zeit war die technisch wichtigste Natriumanwendung die Herstellung von Tetraethylblei aus Chlorethan. Dieses war ein wichtiges Antiklopfmittel, das dem Benzin beigemischt wurde. Aus Umweltschutzgründen wurde die Verwendung von Tetraethylblei stark eingeschränkt oder ganz verboten. Daher ging der Verbrauch an Natrium zurück. Ansonsten wird Natrium in anderen Reaktionen wie der Birch-Reduktion und der Pinakol-Kupplung verwendet.[36] Diese sind jedoch eher im Labormaßstab von Interesse.
Trocknungsmittel
Da Natrium auch mit Spuren von Wasser reagiert, kann frisch gepresster Natriumdraht zur Trocknung organischer Lösungsmittel wie Diethylether oder Toluol, genutzt werden. Für halogenhaltige Lösungsmittel (Beispiele: Methylenchlorid, Chloroform) ist diese Methode wegen der heftigen Reaktion mit dem Chloratom nicht geeignet.
Natrium-Kalium-Legierungen sind bei Raumtemperatur flüssig. Diese dienen zur Wärmeübertragung sowie zur Dehalogenierung in der organischen Synthese. NaK eignet sich gut zum Trocknen einiger bereits gut vorgetrockneter Lösungsmittel, um besonders niedrige Rest-Wassergehalte zu erreichen.
Elektrischer Leiter
Während der 1960er und 1970er Jahre wurde mit Natrium in elektrischen Kabeln als Leitermaterial experimentiert. Aufgrund der hohen Reaktivität mussten diese Kabel zum Schutz vor Umwelteinflüssen wie Feuchtigkeit speziell umhüllt werden, beispielsweise mit Polyethylen.[37] Die geringere elektrische Leitfähigkeit von Natrium, verglichen mit üblichen Leitermaterialen wie Kupfer, konnte in den Experimenten durch einen entsprechend großen Leiterquerschnitt kompensiert werden. So hat ein Kabel aus Natrium bei gleicher Länge und identischem elektrischem Widerstand, aufgrund geringerer Dichte weniger Gewicht als ein Kupferkabel: Eine wirtschaftliche Anwendung in der Praxis hatte sich allerdings nicht ergeben.[38]
| [39] | Natrium | Aluminium | Kupfer |
|---|---|---|---|
| Dichte | 100 | 280 | 910 |
| Gewicht / [Widerstand] | 100 | 160 | 300 |
| Durchmesser / [Widerstand] | 100 | 74 | 57 |
Nachweis

Der qualitative Nachweis erfolgt zunächst atomspektroskopisch durch die intensiv gelbe Flammenfärbung oder genauer über die Na-Doppellinie bei 588,99 nm und 589,59 nm.
Der Nachweis von Natrium auf rein chemischem Weg ist sehr schwierig. Da fast alle Natriumverbindungen gut wasserlöslich sind, sind klassische Fällungsreaktionen und gravimetrische Bestimmungen kaum möglich. Ausnahmen bilden das gelbe Natriummagnesiumuranylacetat[40] NaMg(UO2)3(CH3COO)9·9 H2O und das farblose Natriumhexahydroxoantimonat Na[Sb(OH)6], die beide schwerlöslich sind.[41] Eine Fällungsreaktion mit dem Sulfat-Bismut-Doppelsalz 3Na2SO4·2Bi2(SO4)3·2H2O ist möglich.[42] Da Natriumionen in wässriger Lösung farblos sind, werden Farbreaktionen kaum ausgeführt. Von praktischer Bedeutung sind daher neben der Ionenchromatographie nur noch die spektroskopischen Methoden.
Physiologie
Natrium ist eines der Elemente, die für alle tierischen Organismen essentiell sind. Im tierischen Organismus ist Natrium – zusammen mit Chlor – das neunthäufigste Element und stellt – nach Calcium und Kalium – das dritthäufigste anorganische Ion. Damit zählt es physiologisch zu den Mengenelementen. Natrium liegt in Lebewesen in Form von Na+-Ionen vor.
Im menschlichen Körper sind bei einem durchschnittlichen Körpergewicht von 70 kg etwa 100 g Natrium als Na+-Ionen enthalten.[43] Davon liegen zwei Drittel als NaCl und ein Drittel als NaHCO3 vor. Da es im menschlichen Körper 90 % der extrazellulären Elektrolyte ausmacht, bestimmt die Natriumkonzentration über das Gefäßvolumen das Volumen der interstitiellen Flüssigkeit.[44]
Empfohlene und tatsächliche Natriumzufuhr
Der Schätzwert für die minimale Zufuhr von Natrium liegt laut den D-A-CH-Referenzwerten bei 550 mg/Tag für Erwachsene.[45] Von verschiedenen Organisationen gibt es jedoch insbesondere Empfehlungen für eine maximale Zufuhr von Natrium (WHO: 2 g/Tag;[46] AHA: 1,5 g/Tag[47]).
Die tatsächliche tägliche Natriumzufuhr liegt häufig über diesen Werten. Die Ursache dafür ist unser relativ hoher Salzkonsum (2,5 g Salz enthalten ca. 1 g Natrium). Die Nationale Verzehrsstudie II (NVS II) des Max Rubner-Instituts, bei der der Natriumkonsum anhand von Fragebögen ermittelt wurde, ergab im Median eine Aufnahme von 3,2 g/Tag (Männer) bzw. 2,4 g/Tag (Frauen).[48] Vermutlich liegt die tatsächliche Natriumzufuhr aber noch höher, da die Erfassung über Fragebögen fehleranfällig ist. Als Goldstandard für die Ermittlung der Natriumzufuhr dient die Bestimmung von Natrium im 24-Stunden-Urin. Einem Bericht der WHO zufolge lag in der INTERSALT-Studie die Natriumausscheidung in verschiedenen Orten Deutschlands bei 4,1–4,5 g/Tag (Männer) bzw. 2,7–3,5 g/Tag (Frauen).[49]
Regulation des Natriumhaushalts
Der Natriumgehalt wird streng kontrolliert und ist eng verbunden mit der Regulation des Wasserhaushalts. Die normale Natriumkonzentration im Serum liegt bei etwa 135–145 mmol/l. Ist der Natriumspiegel geringer, wird von einer Hyponatriämie gesprochen, bei der es zu einer Steigerung des Zellvolumens kommt. Bei einer Hypernatriämie dagegen ist der Natriumspiegel zu hoch und die Zellen schrumpfen. In beiden Fällen wird vor allem die Funktion des Gehirns beeinträchtigt. Es kann zu epileptischen Anfällen und Bewusstseinsstörungen bis hin zum Koma kommen. Eine wichtige Rolle für die Regulation spielen das Renin-Angiotensin-Aldosteron-System, das Adiuretin und Atriopeptin.[50]
Schlüsselorgan bei der Regulation von Natrium ist die Niere. Diese ist dafür zuständig, bei einem Natriumüberschuss Wasser zurückzuhalten, um das Natrium im Körper zu verdünnen, und Natrium selbst auszuscheiden. Bei einem Natriummangel wird vermehrt Wasser ausgeschieden und Natrium retiniert. Dabei gilt jedoch zu beachten, dass die Niere einige Zeit braucht, bis sie auf den veränderten Natriumbestand reagieren kann.[51]
Verteilung im Organismus

Im Organismus sind die Na+-Ionen nicht gleichmäßig verteilt, vielmehr sind – wie bei den anderen Ionen auch – die Konzentrationen inner- und außerhalb der Zellen stark verschieden. Diese Konzentrationsgefälle von Na+- und Cl−- (überwiegend außen), K+- sowie organischer Anionen (überwiegend innen) bedingen den Großteil des Membranpotentials lebender Zellen. Dieses Membranpotential und die Ionengradienten sind für die meisten Zellen überlebenswichtig. Da die kleinen anorganischen Ionen wegen der Konzentrationsunterschiede dauernd in den Nachbarbereich wandern, bedarf es eines aktiven Prozesses, der dem entgegensteuert. Die wichtigste Rolle spielt dabei die Natrium-Kalium-Pumpe, die unter Energieverbrauch Na+- und K+-Ionen immer wieder zurückpumpt.[52]
Von der Gesamt-Natrium-Menge im menschlichen Organismus sind lediglich 2,5 % intrazellulär und 2,5 % transzellulär zu finden, während 95 % extrazellulär vorliegen. Der größte Anteil befindet sich mit 45 % des Gesamt-Natriums im Knochen, wobei 30 % nichtaustauschbar im wasserarmen („anhydrous“) Knochen fest gebunden sind, nur 15 % austauschbar sind. Im Plasma finden sich 10 % des Gesamt-Natriums, und ebenfalls 10 % im Bindegewebe, wovon etwa ein Viertel im hypertonen Knorpel gebunden ist. Im interstitiellen Flüssigkeitsraum liegen 30 % des Gesamt-Natriums vor, und dort besteht im physiologischen Zustand ein dreiphasisches Äquilibrium. Neben der Flüssigkeitsphase, die Plasma-artig ist und deren Natriumkonzentration auch der des Plasmas gleicht, besteht eine dichte Kollagen-basierte Matrix, in der ein hydrostatischer Druck besteht. Diesem entgegen wirkt die dritte Phase, die eine Glucosaminoglycan-reiche Gelphase darstellt und durch die negative Ladung der Glucosaminoglycane Kationen wie Natrium anzieht und einen lokalen osmotischen Druck aufbaut.[53]
Funktionen in Nervenzellen
Na+-Ionen spielen eine wichtige Rolle bei der Entstehung und Weiterleitung von Erregungen in Nervenzellen (und Muskelfasern). An den Postsynapsen von Nervenzellen (und an der neuromuskulären Endplatte der Muskelfasern) befinden sich bestimmte Rezeptoren, die sich nach ihrer Aktivierung durch Überträgerstoffe (Neurotransmitter), die von der vorangehenden Nervenzelle bei deren Erregung ausgeschüttet werden, öffnen und für Natriumionen durchlässig werden. Durch Natriumeinstrom kommt es zu einer lokalen Änderung des im Grundzustand stabilen Membranpotentials der Zelle. Das Innere wird gegenüber dem Äußeren weniger negativ, dies heißt eine Depolarisation. Ist diese Depolarisation nach dem Weg bis zum Axon noch stark genug, kommt es zur Öffnung eines anderen Natriumkanaltyps. Dabei handelt es sich um die spannungsabhängigen Natriumkanäle des Axons, die die örtliche Depolarisation – gemeinsam mit anderen Ionenkanälen – durch einen bestimmten Öffnungs- und Schließrhythmus weiterleiten. An den Axonen der Nervenzellen entsteht so eine fortlaufende Spannungswelle, das Aktionspotential. Bei der Wiederherstellung des Grundzustandes spielt wiederum die Natrium-Kalium-Pumpe eine essentielle Rolle.[52]
Natrium bei Pflanzen

Bei Pflanzen spielt Natrium hingegen eine untergeordnete Rolle. Während Kalium für alle Pflanzen und die meisten Mikroorganismen essentiell ist, wird Natrium nur von einigen C4- und CAM-Pflanzen benötigt, von C3-Pflanzen in der Regel jedoch nicht. Je nach Standort haben sich aber davon unabhängig Pflanzen entwickelt, die von einer Natriumaufnahme profitieren können. Diese Pflanzen, Halophyten genannt, kommen besonders in Küstenregionen oder anderen Gebieten vor, in denen der Boden eine hohe Natriumkonzentration aufweist. Halophyten wie die Zuckerrübe, Kohl und viele C4-Gräser sind salztolerant, da sie das Natrium aus dem Zentralzylinder heraus in die Vakuolen der Blattzellen transportieren können, wo es als osmotisch wirksames Ion für eine Erhöhung des Turgors sorgt und dadurch statt des Kaliums die Zellstreckung und das Blattflächenwachstum positiv beeinflusst. Natrium substituiert damit zu einem Teil Kalium, zu einem anderen Teil wirkt es aber auch zusätzlich wachstumsfördernd.
Pflanzen, die Natrium nicht aus dem Zentralzylinder heraus in die Blattzellen transportieren können, akkumulieren es im Xylemparenchym. Zu diesen sogenannten natrophoben Pflanzen gehören u. a. Buschbohne und Mais. Das Natrium, gelangte es in die Blattzellen, könnte nicht in die Vakuolen transportiert werden, sondern verbliebe im Zellplasma (Cytosol) und würde dort das für die Bildung von Polymeren wichtige Kalium verdrängen (natriuminduzierter Kaliummangel). Dieses führte schließlich zu einer Hemmung der Photosynthese. Die Akkumulation von Natrium im Zentralzylinder der Wurzel und im Stängelgewebe wirkt sich aber bei hoher Natriumkonzentration negativ für die Pflanze aus. Durch die Erhöhung des osmotischen Wertes wird sie bei der Wasseraufnahme und dem Wassertransport behindert. Es kommt zu einer Wasser- und Nährstoffunterversorgung der Blätter, was zu einer Verringerung der Photosyntheseleistung führt.[54][55]
Da die meisten Pflanzen Natrium nur in geringen Mengen enthalten, müssen viele Pflanzenfresser zusätzliches Natriumchlorid aus natürlichen Salzvorkommen aufnehmen.
Sicherheitshinweise
Kleinere Mengen Natrium werden unter Petroleum aufbewahrt. Für größere Mengen gibt es integrierte Handhabungssysteme mit Schutzgasatmosphäre. Das Natrium ist trotz Schutzgas oder Petroleum häufig von einer Schicht aus Natriumhydroxid und Natriumoxid überzogen.
Natriumbrände lassen sich mit Metallbrandpulver (Kochsalz), Kaliumchlorid, Grauguss-Spänen, behelfsweise mit Sand oder trockenem Zement löschen. Sand und Zement reagieren jedoch in gewissem Rahmen mit Natrium, was die Löschwirkung mindert. Keinesfalls dürfen Wasser, Schaum, Löschpulver, Kohlenstoffdioxid oder Halone verwendet werden. Diese Löschmittel reagieren mit Natrium zum Teil stark exotherm, was gegebenenfalls zu stärkeren Bränden und Explosionen führen kann.
Verbindungen
In Verbindungen kommt das Natrium ausschließlich in der Oxidationsstufe +1 vor. Alle Verbindungen weisen einen stark ionischen Charakter auf, fast alle sind gut wasserlöslich. Natriumverbindungen zählen zu den wichtigsten Salzen vieler Säuren. Industriell werden meist Natriumsalze zur Gewinnung der entsprechenden Anionen verwendet, da deren Synthese kostengünstig ist.
Halogenverbindungen
Natriumchlorid (NaCl), häufig als Speisesalz oder Kochsalz bezeichnet, ist das wichtigste und bekannteste Natriumsalz. Da es in großen Mengen vorkommt, ist es der wichtigste Rohstoff für die Gewinnung von Natrium und anderen Natriumverbindungen. Natriumchlorid stellt für den Menschen die wichtigste Natriumquelle dar. Technisch wird es unter anderem zur Konservierung von Lebensmitteln und als Streusalz im Straßenverkehr genutzt. Es ist Namensgeber für die Natriumchlorid-Struktur, eine für viele Salze typische Kristallstruktur.
Daneben sind alle anderen möglichen Natriumhalogenide, also Natriumfluorid NaF, Natriumbromid NaBr und Natriumiodid NaI, bekannt und stabil.
Sauerstoffverbindungen
Es sind insgesamt fünf Oxide des Natriums bekannt. Dies sind Natriumoxid Na2O, Natriumperoxid Na2O2, Natriumhyperoxid NaO2, Dinatriumtrioxid Na2O3 und Natriumtrioxid NaO3. Natriumoxid ist in vielen Gläsern enthalten, es entsteht bei der Glasherstellung aus dem eingesetzten Natriumcarbonat. Bei der Verbrennung von Natrium entsteht es nur bei bestimmten Temperaturen (150–200 °C[19]) und stöchiometrisch eingesetzten Mengen Natrium und Sauerstoff. Ist dies nicht der Fall, verbrennt Natrium zu Natriumperoxid. Dieses ist ein starkes Oxidationsmittel und das technisch wichtigste Natriumoxid. Es wird als Bleichmittel für Textilien und Papier sowie als Sauerstoffquelle beim Tauchen und in U-Booten verwendet. Die anderen Oxide sind sehr instabil und zersetzen sich schnell.
Natriumhydroxid (NaOH) ist für die Industrie mit die wichtigste Base. Die wässrige Lösung von Natriumhydroxid wird Natronlauge genannt. Sie wird unter anderem für die Herstellung von Seife und Farbstoffen sowie zum Aufschluss von Bauxit bei der Aluminiumproduktion verwendet.
Schwefelverbindungen
Mit Schwefelwasserstoff bildet Natrium zwei Salze, das Natriumsulfid Na2S und das Natriumhydrogensulfid NaHS. Beide werden u. a. zur Schwermetallfällung verwendet.
Natriumsulfat Na2SO4, das Natriumsalz der Schwefelsäure, wird u. a. in Waschmitteln und in der Papierindustrie im Sulfatverfahren eingesetzt. Wie andere zweiwertige Anionen bildet Sulfat neben dem Natriumsulfat noch Natriumhydrogensulfat. Auch andere Schwefel-Sauerstoffsäuren bilden Natriumsalze. Ein Beispiel ist Natriumthiosulfat Na2S2O3, das in der Analogfotografie als Fixiersalz verwendet wird.
Hydride
In Natriumhydrid NaH und Natriumborhydrid NaBH4 liegt der Wasserstoff in der Oxidationsstufe −1 vor. Beide werden vorwiegend in der organischen Chemie verwendet. Natriumhydrid wird dabei im Wesentlichen als starke, wenig nucleophile Base zur Deprotonierung von Thiolen, Alkoholen, Amiden, CH-aciden Verbindungen etc. eingesetzt, Natriumborhydrid hingegen zur Reduktion z. B. von Ketonen. Letztere Reaktion kann durch Gegenwart von Cer(III)-Verbindungen selektiv für Ketone durchgeführt werden (Luche-Reduktion). Kommen sie mit Wasser in Berührung, entsteht gasförmiger Wasserstoff H2.
Weitere Natriumverbindungen
Natriumcarbonat Na2CO3 und Natriumhydrogencarbonat NaHCO3 sind die Natriumsalze der Kohlensäure. Sie zählen, neben Natriumchlorid und Natriumhydroxid, zu den wichtigsten Natriumverbindungen. Natriumcarbonat (häufig mit dem Trivialnamen Soda bezeichnet) wird in großen Mengen bei der Glasherstellung benötigt. Natriumhydrogencarbonat wird als Backpulver verwendet. Es bildet beim Erhitzen mit Säuren Kohlenstoffdioxid und Wasser.
Natriumnitrat NaNO3, das Natriumsalz der Salpetersäure, ist eine der seltenen natürlich vorkommenden Nitratverbindungen (Chilesalpeter). Natriumnitrat wird als Düngemittel und als Konservierungsmittel verwendet.
Organische Verbindungen des Natriums sind im Gegensatz zu denen des Lithiums sehr instabil. Sie sind äußerst reaktiv und können teilweise mit sonst unreaktiven aliphatischen Kohlenwasserstoffen reagieren. Ausreichend stabil für Anwendungen in Reaktionen sind nur Verbindungen mit aromatischen Resten, wie Cyclopentadien, die als Reduktionsmittel verwendet werden können.[56]
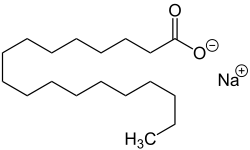
Seifen sind Natrium- oder Kaliumsalze von Fettsäuren. Zur Herstellung werden Fette mit einer Natronlauge oder Kalilauge gekocht. Dieses Verfahren heißt Seifensieden, die chemische Reaktion Verseifung. Die Fette werden dabei in Glycerin und in die Alkalisalze der Fettsäuren (die eigentlichen Seifen) zerlegt. Alternativ lassen sich Seifen direkt aus freien Fettsäuren herstellen, indem sie mit Laugen zu ihren Salzen umgesetzt werden. Geeignete Fettsäuren sind beispielsweise Laurinsäure, Myristinsäure, Palmitinsäure, Stearinsäure, Ölsäure und Ricinolsäure.[57]
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH Verlagsgesellschaft, Weinheim 1988, ISBN 3-527-26169-9.
- David M. Adams: Inorganic Solids. Wiley, London 1974, ISBN 0-471-00470-7.
Einzelnachweise
- ↑ Harry H. Binder: Lexikon der chemischen Elemente. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.
- ↑ Die Werte für die Eigenschaften (Infobox) sind, wenn nicht anders angegeben, aus
 www.webelements.com (Natrium) entnommen.
www.webelements.com (Natrium) entnommen.
- ↑ Michael E. Wieser, Tyler B. Coplen: Atomic weights of the elements (IUPAC Technical Report). In: Pure and Applied Chemistry. Vol. 83, No. 2, 2011, S. 359–396.
- ↑
 IUPAC, Standard Atomic Weights Revised 2013 (Exel-Datei).
IUPAC, Standard Atomic Weights Revised 2013 (Exel-Datei).
- ↑ Hochspringen nach: a b c
d e Eintrag zu
 sodium
in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST,
Gaithersburg, MD.
doi:
sodium
in Kramida, A., Ralchenko, Yu., Reader, J. und NIST ASD Team (2019): NIST Atomic Spectra Database (ver. 5.7.1). Hrsg.: NIST,
Gaithersburg, MD.
doi:  10.18434/T4W30F
(
10.18434/T4W30F
(  physics.nist.gov/asd).
physics.nist.gov/asd).
- ↑ Hochspringen nach: a b c
d e Eintrag zu
 sodium bei WebElements,
sodium bei WebElements,  www.webelements.com.
www.webelements.com.
- ↑ N. N. Greenwood, A. Earnshaw: Chemie der Elemente. 1. Auflage. VCH, Weinheim 1988, ISBN 3-527-26169-9, S. 97.
- ↑ Robert C. Weast (Hrsg.): CRC Handbook of Chemistry and Physics. CRC (Chemical Rubber Publishing Company), Boca Raton 1990, ISBN 0-8493-0470-9, S. E-129 bis E-145. Werte dort sind auf g/mol bezogen und in cgs-Einheiten angegeben. Der hier angegebene Wert ist der daraus berechnete maßeinheitslose SI-Wert.
- ↑ Hochspringen nach: a b Yiming Zhang, Julian R. G. Evans, Shoufeng Yang: Corrected Values for Boiling Points
and Enthalpies of Vaporization of Elements in Handbooks. In: Journal of Chemical & Engineering Data. 56, 2011, S. 328–337,
 doi:10.1021/je1011086.
doi:10.1021/je1011086.
- ↑ A. Klemm, G. Hartmann, L. Lange: Sodium and Sodium Alloys. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH Verlag, Weinheim 2005,
 doi:10.1002/14356007.a24_277.
doi:10.1002/14356007.a24_277.
- ↑ Ludwig Bergmann, Clemens Schaefer, Rainer Kassing: Lehrbuch der Experimentalphysik. Band 6: Festkörper. 2. Auflage. Walter de Gruyter, 2005, ISBN 3-11-017485-5, S. 361.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 84. Auflage. CRC Press, Boca Raton, Florida 2003.
- ↑ Hochspringen nach: a b Datenblatt
 Natrium bei
Merck.
Natrium bei
Merck.
- ↑ Eintrag zu
 Sodium in der Datenbank ECHA CHEM der
Europäischen Chemikalienagentur (ECHA). Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
Sodium in der Datenbank ECHA CHEM der
Europäischen Chemikalienagentur (ECHA). Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
 erweitern.
erweitern.
- ↑ Hochspringen nach: a b
 Mineralienatlas: Natrium.
Mineralienatlas: Natrium.
- ↑ David Stifter: Hallstatt – In eisenzeitlicher Tradition?
In: Raimund Karl, Jutta Leskovar (Hrsg.): Interpretierte Eisenzeiten. Fallstudien, Methoden, Theorie. Tagungsbeiträge der 1. Linzer Gespräche zur interpretativen Eisenzeitarchäologie
(= Studien zur Kulturgeschichte von Oberösterreich. Folge 18). Linz 2005, ISBN 978-3-85474-137-4,
S. 229–240
(
 ooekultur.at [PDF; 344 kB]).
ooekultur.at [PDF; 344 kB]).
- ↑ A. G. W. Cameron: Abundances of the elements in the solar system. In: Space Science Reviews. 15, 1970, S. 121–146;
 doi:10.1007/BF00172440.
doi:10.1007/BF00172440.
- ↑ K. H. Wedepohl: The composition of the continental crust. In:
Geochimica et Cosmochimica Acta. 59, 7, 1995, S. 1217–1232;
 doi:10.1016/0016-7037(95)00038-2.
doi:10.1016/0016-7037(95)00038-2.
- ↑ Hochspringen nach: a b c d e f g h A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- ↑ Patent
 US1501756A: Electrolytic process and cell. Angemeldet am
18. August 1922, veröffentlicht am 15. Juli 1924, Anmelder: Roessler & Hasslacher Chemical Company, Erfinder: James Cloyd Downs.
US1501756A: Electrolytic process and cell. Angemeldet am
18. August 1922, veröffentlicht am 15. Juli 1924, Anmelder: Roessler & Hasslacher Chemical Company, Erfinder: James Cloyd Downs.
- ↑ Zusammenfassung über Alkalimetalle von wiley-vch.
- ↑ Hochspringen nach: a b K. Schubert: Ein Modell für die Kristallstrukturen der chemischen Elemente.
In: Acta Crystallographica. B30, 1974, S. 193–204;
 doi:10.1107/S0567740874002469.
doi:10.1107/S0567740874002469.
- ↑
 Natrium bei webelements.com,
physikalische Eigenschaften.
Natrium bei webelements.com,
physikalische Eigenschaften.
- ↑ G. L. C. M. van Rossen, H. van Bleiswijk: Über das Zustandsdiagramm der Kalium-Natriumlegierungen. In:
Zeitschrift für anorganische Chemie. Band 74, 1912, S. 152–156;
 doi:10.1002/zaac.19120740115.
doi:10.1002/zaac.19120740115.
- ↑ P. E. Mason, F. Uhlig, V. Vaněk, T. Buttersack, S. Bauerecker, P. Jungwirth: Coulomb explosion during the early stages of the reaction of alkali metals with water.
In: Nature chemistry. Band 7, Nummer 3, März 2015, S. 250–254,
 doi:10.1038/nchem.2161.
doi:10.1038/nchem.2161.
 PMID 25698335.
PMID 25698335.
- ↑ D. L. Ward, R. H. Huangj, J. L. Dye: The Structures of Alkalides and Electrides. III. Structure of Potassium Cryptand[2.2.2] Natride. In: Acta Cryst. C46, 1990, S. 1833–1835.
- ↑ Hochspringen nach: a b c G. Audi, F. G. Kondev, Meng Wang, W.J. Huang,
S. Naimi: The NUBASE2016 evaluation of nuclear properties. In: Chinese Physics C. 41, 2017, S. 030001,
 doi:10.1088/1674-1137/41/3/030001
(
doi:10.1088/1674-1137/41/3/030001
(  Volltext).
Volltext).
- ↑ C. Naidoo, N.P. van der Meulen, C Vermeulen, R. Krause-Rehberg: The Production of 22Na Positron Sources at iTHEMBA Labs.
- ↑ Patent
 US5487880A: Production of sodium-22 from proton irradiated aluminum. Angemeldet am
30. November 1993, veröffentlicht am 30. Januar 1996, Anmelder: The Regents of the University of California Office of Technology Transfer,
Erfinder: Wayne A. Taylor et al.
US5487880A: Production of sodium-22 from proton irradiated aluminum. Angemeldet am
30. November 1993, veröffentlicht am 30. Januar 1996, Anmelder: The Regents of the University of California Office of Technology Transfer,
Erfinder: Wayne A. Taylor et al.
- ↑ N.Fukuda et al.: New isotope 39Na and the neutron dripline of neon isotopes using a 345 MeV /nucleon 48Ca beam In:
Riken accel. Program Rep 51 (2018) (
 Volltext PDF).
Volltext PDF).
- ↑
 Salted Bombs. In: Calculating.
21. Dezember 2014, abgerufen am 27. März 2023 (englisch).
Salted Bombs. In: Calculating.
21. Dezember 2014, abgerufen am 27. März 2023 (englisch).
- ↑ stud.uni-giessen.de: Reaktion von Natrium mit Wasser.
- ↑ K. Ziegler, F. Bersch, H. Wollthan: Untersuchungen über alkaliorganische Verbindungen. XI. Der Mechanismus der Polymerisation ungesättigter Kohlenwasserstoffe durch Alkalimetalle und Alkalialkyle. In: Justus Liebigs Annalen der Chemie. 511, 1, 1934, S. 13–44; doi:10.1002/jlac.19345110103.
- ↑
 Deutsches Chemie-Museum Merseburg, Geschichte der Busa-Werke Schkopau.
Deutsches Chemie-Museum Merseburg, Geschichte der Busa-Werke Schkopau.
- ↑ M. Volkmer: Basiswissen Kernenergie. Hamburgische Elektricitäts-Werke-AG, 1996, ISBN 3-925986-09-X, S. 52–53.
- ↑ R. Brückner: Reaktionsmechanismen. 3. Auflage. Spektrum Akad. Verlag, 2004, ISBN 3-8274-1579-9.
- ↑ Patentanmeldung
 DE1765288A1: Isoliertes Natriumkabel und Verfahren zu dessen Herstellung. Angemeldet am
27. April 1968, veröffentlicht am 15. Juli 1971, Anmelder: General Electric Co, Erfinder: Carl Asa Bailey, Raymond Erick Isaacson.
DE1765288A1: Isoliertes Natriumkabel und Verfahren zu dessen Herstellung. Angemeldet am
27. April 1968, veröffentlicht am 15. Juli 1971, Anmelder: General Electric Co, Erfinder: Carl Asa Bailey, Raymond Erick Isaacson.
- ↑
 Assessment of sodium conductor distribution cable.
Westinghouse Research and Development Center, Pittsburgh, 1979, abgerufen am 28. Januar 2025 (englisch).
Assessment of sodium conductor distribution cable.
Westinghouse Research and Development Center, Pittsburgh, 1979, abgerufen am 28. Januar 2025 (englisch).
- ↑ G. F. Moore (Hrsg.): Electric Cables Handbook. 3. Auflage. Blackwell Science, 1997, ISBN 0-632-04075-0, S. 80.
- ↑ F. Kögler: Die Bestimmung von Natrium als Natrium-Magnesium-Uranylacetat. In: Angewandte Chemie. 48, 1935, S. 561–565, doi:10.1002/ange.19350483403.
- ↑
 Wissenschaft-Online-Lexika: Eintrag zu Natrium im Lexikon der Chemie.
Wissenschaft-Online-Lexika: Eintrag zu Natrium im Lexikon der Chemie.
- ↑ Eintrag zu
 Natrium. In:
Römpp Online. Georg Thieme Verlag.
Natrium. In:
Römpp Online. Georg Thieme Verlag.
- ↑ W. Kaim, B. Schwederski: Bioanorganische Chemie. 4. Auflage. Teubner, Wiesbaden 2005, ISBN 3-519-33505-0.
- ↑ P. Deetjen, E.-J. Speckmann, J. Hescheler: Physiologie. Elsevier, München 2005.
- ↑ Deutsche Gesellschaft für Ernährung e. V. Referenzwerte für die Nährstoffzufuhr (vom 11. November 2014 im Internet Archive).
- ↑ World Health Organization:
 Reduzierung der
Natrium-/Salzaufnahme der Bevölkerung. Abgerufen am 05.07. 2025.
Reduzierung der
Natrium-/Salzaufnahme der Bevölkerung. Abgerufen am 05.07. 2025.
- ↑ American Heart Association The American Heart Association’s Diet and Lifestyle Recommendations. Abgerufen am 13. Dezember 2013.
- ↑ Max Rubner-Institut, Bundesforschungsinstitut für Ernährung und Lebensmittel
 Nationale Verzehrsstudie II. Ergebnisbericht Teil 2. Die bundesweite Befragung zur Ernährung von Jugendlichen und Erwachsenen.
(PDF; 3,3 MB).
Nationale Verzehrsstudie II. Ergebnisbericht Teil 2. Die bundesweite Befragung zur Ernährung von Jugendlichen und Erwachsenen.
(PDF; 3,3 MB).
- ↑ P. Elliott, I. Brown: Sodium intakes around the world. Background document prepared for the Forum and Technical meeting on Reducing Salt Intake in Populations (Paris 5-7th October 2006).
- ↑ W. Siegenthaler (Hrsg.): Klinische Pathophysiologie. 9. Auflage. Georg Thieme Verlag, Stuttgart 2006, ISBN 3-13-449609-7, S. 165–175.
- ↑ P. Deetjen, E.-J. Speckmann, J. Hescheler: Physiologie. Elsevier, München 2005.
- ↑ Hochspringen nach: a b Müller-Esterl: Biochemie. Eine Einführung für Mediziner und Naturwissenschaftler. Spektrum Akademischer Verlag, 2004, ISBN 3-8274-0534-3.
- ↑ David H. Ellison, Paul Wlling: Insights into salt handling and blood pressure New England Journal of Medicine 2021, Band 385, Ausgabe 21 vom 18. November 2021, Seiten 1981–1993,
 doi:10.1056/NEJMra2030212
doi:10.1056/NEJMra2030212
- ↑ P. Sitte, E. W. Weiler u. a.: Strasburger. Lehrbuch der Botanik. 35. Auflage. Spektrum Akademischer Verlag, 2002, ISBN 3-8274-1010-X.
- ↑ K. Mengel: Ernährung und Stoffwechsel der Pflanze. 7. Auflage. Gustav Fischer Verlag, Jena 1991, ISBN 3-334-00310-8, S. 347–349.
- ↑ Chr. Elschenbroich: Organometallchemie. 5. Auflage. Teubner, 2005.
- ↑ Hans-Dieter Jakubke, Ruth Karcher (Hrsg.): Lexikon der Chemie. Spektrum Akademischer Verlag, Heidelberg, 2001.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 21.12. 2025