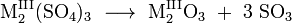Sulfate
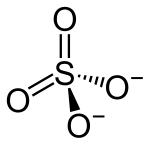
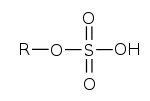
monoester
Sulfate sind eine Gruppe chemischer Verbindungen, die sich von der Schwefelsäure ableiten. Aufteilen lässt sich die Gruppe in Schwefelsäure-Salze und Schwefelsäure-Ester. Die Schwefelsäure besitzt zwei Hydroxy-Gruppen (OH-Gruppen), deren Wasserstoff-Atome abgespalten oder getauscht werden können. Durch Abspaltung dieser H-Atome entstehen aus der Schwefelsäure negativ geladene Anionen: Sulfat [SO4]2− oder Hydrogensulfat [HSO4]−. Diese bilden zusammen mit einem positiv geladenen Gegenion (zum Beispiel Natrium) die Schwefelsäure-Salze, beispielsweise Natriumsulfat (Na2SO4). Bei den Schwefelsäure-Estern sind stattdessen die H-Atome gegen organische Gruppen ausgetauscht. Bei den Monoestern ist ein H-Atom ausgetauscht, bei den Diestern beide.
Die Schwefelsäure ist eine starke Säure, sodass sie in Wasser gelöst überwiegend deprotoniert vorliegt, das heißt als Hydrogensulfat-Ionen. Durch die Abgabe der Wasserstoff-Ionen (H+) wird die Lösung sauer. Schwefelsäure und Hydrogensulfat entstehen in der Atmosphäre durch industrielle Abgase und Vulkanausbrüche und bilden sogenannte Sulfat-Aerosole. Diese sind mitverantwortlich für sauren Regen. Sulfat-Ionen sind in der Umwelt verbreitet, so sind sie nach Chlorid-Ionen die zweithäufigsten Anionen im Meerwasser. Auch in Mineralwasser, in Lebensmitteln und in Salzseen kommen sie vor. Sulfat-Ionen bilden mit Metallen Salze, die zum Teil natürlich als Minerale vorkommen. Das häufigste Salz der Schwefelsäure ist das Calciumsulfat. Es tritt natürlich in mehreren Formen auf, unter anderem als Gips CaSO4·2H2O mit zwei Molekülen Kristallwasser. Ein weiteres häufig vorkommendes Salz ist das Bariumsulfat, das natürlich als Baryt (Schwerspat) vorkommt.
Nomenklatur
Primäre und sekundäre Sulfate
Die Salze der zweibasigen Säure Schwefelsäure (H2SO4) lassen sich in Sulfate und Hydrogensulfate einteilen (auch als primäre und sekundäre Sulfate bezeichnet). Bei einwertigen Kationen MI gelten die Summenformeln MIHSO4 und MI2SO4:
| Hydrogensulfate (primäre Sulfate) | sekundäre Sulfate | |
|---|---|---|
| Synonyme | saure Sulfate Hydrogensulfate Bisulfate |
neutrale Sulfate normale Sulfate |
| Beispiele | Natriumhydrogensulfat,
NaHSO4 Calciumhydrogensulfat, Ca(HSO4)2 |
Natriumsulfat,
Na2SO4 Calciumsulfat, CaSO4 |
Alaune und Vitriole
Alaune sind Doppelsalze aus ein- und dreiwertigen Kationen mit der allgemeinen Summenformel MIMIII(SO4)2 · 12 H2O, Hauptvertreter der Gruppe der Alaune ist das Kaliumaluminiumsulfat (Kalialaun). Vitriole hingegen sind die kristallwasserhaltigen Sulfate zweiwertiger Nebengruppen-Metalle (Kupfervitriol, Eisenvitriol etc.).
Sulfatkomplexe
Sulfatgruppen können in Komplexen als Liganden auftreten. Die Liganden werden in diesem Fall als [Tetraoxosulfato(−2)] oder [Sulfato(−2)] bezeichnet. Nach Empfehlungen zur Nomenklatur tragen auch Sulfitgruppen (SO3)2− das Suffix -sulfat und werden als Trioxosulfat bzw. [Trioxosulfat(IV)] bezeichnet.
Ester der Schwefelsäure

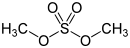
Schwefelsäureester werden gelegentlich auch als Sulfate bezeichnet, da die Namen häufig auf -sulfat enden. Einfache Ester wie Dimethylsulfat sind kräftige Alkylierungsmittel. Ester mit längeren Kohlenwasserstoffresten sowie Sulfonsäure-Salze sind in der Regel Tenside. Zu diesen Estern gehören auch die anwendungstechnisch wichtigen Fettalkoholsulfate.
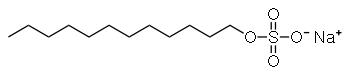
- Monoester; Beispiel: Natriumlaurylsulfat,
ein Tensid,
das in Shampoos
verwendet wurde.
- Diester; Beispiel: Dimethylsulfat,
ein Reaktant,
der in Labor und Technik zur Methylierung
verwendet wird.
Eigenschaften
Allgemeines
Die meisten Sulfate sind in Wasser löslich. Ausnahmen bilden die wenig oder schwerlöslichen Sulfate der ErdalkalimetalleCalcium, Strontium und Barium sowie Blei(II)-sulfat.
Besonders die Alkali- und Erdalkalisulfate sind thermisch äußerst stabil. Sulfate dreiwertiger Metallkationen zersetzen sich in der Wärme zu den entsprechenden Oxidenund Schwefeltrioxid:
Hydrogensulfate sind als Salze der Alkalimetalle bekannt. Sie sind löslich in Wasser. Beim Erhitzen dieser Salze bilden sich Disulfate, Salze der Dischwefelsäure.
Anionen und pH-Wert
Schwefelsäure ist eine starke zweiprotonige Säure. In einer einmolaren, wässrigen Lösung der Säure liegen so gut wie keine H2SO4-Moleküle, sondern im Wesentlichen HSO4−-Ionen vor. Nur gut 1 % der HSO4−-Ionen deprotonieren zu SO42−. Das Hydrogensulfat-Anion (HSO4−) kann sowohl als Säureals auch als Base wirken, es ist also amphoter. Der pKS-Wert des Hydrogensulfat-Ions liegt bei 1,89.
Löst man ein Hydrogensulfatsalz in Wasser, bildet sich in einer Gleichgewichtsreaktion eine Mischung von Hydrogensulfat- und Sulfationen. Daher kann man Hydrogensulfate als mittelstarke Säure einsetzen, wobei die Säurestärke erheblich höher ist als die von Essigsäure (pKS = 4,76). Aufgrund dieser Eigenschaften können Hydrogensulfate auch in Pufferlösungen verwendet werden. Der Pufferbereich liegt im stark sauren Bereich. Wegen ihrer sauren Reaktion in Wasser werden sie beispielsweise in WC-Reinigern eingesetzt.
| Gleichgewichtsreaktionen | Gleichgewichtskonstante bei 25 °C | 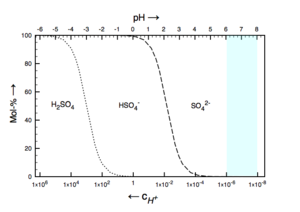 | |
|---|---|---|---|
| (1) | 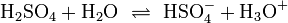 |
![K_{a1}=\mathrm{\frac{[HSO_4^{-}][H_3O^+]}{[H_2SO_4]}}\simeq 1\times10^{3}](/png/9c1930de2203cb033cf5685069afd681.png) | |
| (2) | 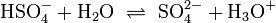 |
![K_{a2}=\mathrm{\frac{[SO_4^{2-}][H_3O^+]}{[HSO_4^{-}]}}\simeq 1{,}3\times10^{-2}](/png/9645cd894819fab7192ec410631620fc.png) |
Vorkommen
Sulfate stellen für viele metallische Elemente die wichtigsten mineralischen Verbindungen dar. Quellen des Sulfates im Bodengestein sind z.B. Anhydrit (CaSO4), Gips (CaSO4 · 2 H2O) und Alabaster (CaSO4 · 2 H2O). Biologische Quelle sind (bakterielle) Sulfatbildungen aus Sulfid und schwefelhaltigen Biomasse-Bestandteilen (z.B. Proteinen). Sulfate kommen in unterschiedlichen Mengen im Grundwasser vor. Für daraus gewonnenes Trinkwasser gilt nach der deutschen Trinkwasserverordnung ein Grenzwert von 250 mg/l.
Struktur des Sulfations
.png)
Das Sulfation ist tetraedrisch gebaut, die S-O-Bindungen sind alle gleichwertig und gleich lang. Die Bindungsverhältnisse können entweder durch mesomere Grenzstrukturen mit delokalisierten π-Bindungen und zwei negativ geladenen Sauerstoffatomen oder durch Ladungstrennung mit zweifach positiv geladenem Schwefelatom und negativer Ladung an jedem Sauerstoffatom beschrieben werden. Es ist isoelektronisch mit dem Perchloration. Aus dem Molekülorbitaldiagramm geht hervor, wie die Bindung und die Hypervalenz erklärt werden kann. Es wird ein zweifach positiv geladenes Schwefelatom mit vier einfach besetzten Atomorbitalen angenommen. Diese Orbitale werden mit vier einfach besetzten 2p-Orbitalen aus den einfach negativ geladenen Sauerstoffatomen kombiniert. Es entstehen vier bindende und vier antibindende σ-Orbitale, von denen nur die bindenden vollständig aufgefüllt sind, und damit das tetraedrische Molekülgerüst mit vier lokalisierten Einfachbindungen. Die unbesetzten antibindenden σp*-Orbitale werden anschließend mit je einem voll besetzten p-Orbital dreier Sauerstoffatome kombiniert, es entstehen drei bindende und drei antibindende π-Orbitale, wovon wieder nur die bindenden Orbitale besetzt sind. Es resultieren drei π-Bindungen, die über das gesamte Molekül, also über das Schwefelatom und alle vier Sauerstoffatome, delokalisiert sind.
Nachweis
Sulfate werden chemisch mit Bariumchlorid oder Bariumhydroxidlösung in Salzsäurenachgewiesen. Dabei entsteht ein schwerlöslicher Niederschlag aus weißem Bariumsulfat:
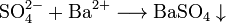
- Sulfat-Ionen bilden mit Barium-Ionen einen weißen, säureunlöslichen Niederschlag von Bariumsulfat.
Die Säure
wird zur Entstörung zugesetzt, da andere Anionen wie Carbonatoder Sulfit mit Barium in Wasser
ebenfalls schwerlösliche, aber in Säuren lösliche Salze bilden.
In der Wasseranalytik finden für die quantitative Bestimmung auch titrimetrische Verfahren Anwendung.
Beispiele
- Eisen(II)-sulfat (FeSO4) Grünsalz, kristallwasserhaltig auch als Eisenvitriol bezeichnet
- Mangan(II)-sulfat (MnSO4, kristallwasserhaltig auch als Manganvitriol bezeichnet, blassrosa)
- Zinksulfat (ZnSO4 · 7 H2O, Zinkvitriol)
Prototypen der Vitriole, Alaune und weiterer Sulfate sind:
| |||||||||||||||||||||||||||

© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 08.03. 2025