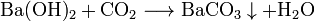Bariumhydroxid
| Sicherheitshinweise | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| MAK | 0,5 mg/m3 | |||||||||||||||
Bariumhydroxid Ba(OH)2 ist das Hydroxid des Erdalkalimetalls Barium. Es ist in wässriger Lösung eine starke Base.
| Kristallstruktur | |
|---|---|
 | |
| Allgemeines | |
| Name | Bariumhydroxid |
| Andere Namen |
|
| Verhältnisformel | Ba(OH)2 |
| CAS-Nummer |
|
| Kurzbeschreibung | weißer Feststoff |
| Eigenschaften | |
| Molare Masse | 171,34 g/mol |
| Aggregatzustand | fest |
| Dichte |
|
| Schmelzpunkt |
|
| Siedepunkt | Zersetzung bei > 600 °C zu Bariumoxid und Wasser |
| Löslichkeit | Löslich in Wasser (72 g·/l |
| Thermodynamische Eigenschaften | |
| ΔHf0 | −944,7 kJ/mol |
Gewinnung und Darstellung
Ausgehend vom Schwerspat (Bariumsulfat) BaSO4 wird Bariumhydroxid aus Bariumoxid oder Bariumsulfid gewonnen: Bariumoxid reagiert mit Wasser zum Bariumhydroxid:
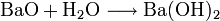 ,
,
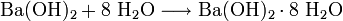 .
.
Bariumsulfid reagiert mit Wasser zu Bariumhydroxid und Schwefelwasserstoff:
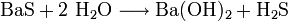 .
.
Eigenschaften
Physikalische Eigenschaften
Bariumhydroxid ist eine feste, aus farblosen Kristallen bestehende Substanz. Es bildet zwei Hydrate, ein Monohydrat und ein Octahydrat. Die Löslichkeit in Wasser ist stark temperaturabhängig, bei 20 °C lösen sich 56 g/l Wasser, bei 80 °C 947 g/l Wasser. Die wässrige Lösung, auch Barytwasser genannt, reagiert stark alkalisch, da Bariumhydroxid fast vollständig in Ionen dissoziiert. Eine gesättigte Lösung hat einen pH-Wert von 14.
Chemische Eigenschaften
Bariumhydroxid bildet in wässriger Lösung mit Kohlenstoffdioxid oder anderen carbonathaltigen Salzen einen schwer löslichen Niederschlag aus Bariumcarbonat:
Es kann so zum qualitativen Nachweis von Carbonationen herangezogen werden.
Verwendung
- Glas- und Keramikherstellung. Teilweise als Ersatz für Bariumcarbonat
- Wasserenthärtung
- Im 18. Jahrhundert in Verbindung mit Ammoniumthiocyanat zur Eisherstellung verwendet, aufgrund der stark endothermen Reaktion. (Reaktion ist exergonisch.)
- Zum Nachweis von Kohlenstoffdioxid und Carbonaten
- Das Octahydrat kann als Wärmespeicher verwendet werden


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 03.04. 2022