Molekül
Moleküle von lat. molecula, „kleine Masse“) sind im weiten Sinn zwei- oder mehratomige Teilchen, die durch chemische Bindungen zusammengehalten werden und wenigstens so lange stabil sind, dass sie z.B. spektroskopisch beobachtet werden können. Es kann sich um neutrale Teilchen, aber auch um Radikale, Ionen oder auch ionische Addukte handeln. So sind z.B. viele Typen von interstellaren Molekülen unter irdischen Bedingungen nicht stabil. Die International Union of Pure and Applied Chemistry (IUPAC) nennt solche Teilchen molekulare Gebilde (molecular entity).
Grundsätzliches
Im engen Sinn und im allgemeinen Sprachgebrauch der Chemie sind Moleküle elektrisch neutrale Teilchen, die aus zwei oder mehreren Atomen aufgebaut sind. Die Atome bilden einen in sich abgeschlossenen, chemisch abgesättigten Verband und sind kovalent miteinander verknüpft. Ein so definiertes Molekül ist das kleinste Teilchen eines bestimmten Reinstoffes und hat eine bestimmbare Molekülmasse. Ein Molekül ist kein starres Gebilde, bei Energiezufuhr treten unterschiedliche Molekülschwingungen auf.
Moleküle können aus Atomen eines einzigen chemischen Elementsaufgebaut sein, wie Sauerstoff (O2) und Stickstoff (N2) (Elementmoleküle). Meist sind Moleküle jedoch Verbände von Atomen verschiedener Elemente, wie Wasser (H2O) und Methan (CH4). Die Anordnung der Atome (ihre Konstitution) in einem Molekül sind durch die chemischen Bindungen fixiert. So unterscheiden sich trotz gleicher Anzahl der beteiligten Atomen Ethanol (H3C–CH2–OH) von Dimethylether (H3C–O–CH3) und werden durch unterschiedliche chemische Formeln dargestellt. In bestimmten Fällen können Moleküle wie z.B. die Moleküle der Milchsäure Formen mit gleicher Konstitution, aber unterschiedlicher räumlicher Anordnung (der Konfiguration) vorliegen. Dass gleiche Summenformeln unterschiedliche Moleküle zulassen, wird allgemein Isomerie genannt.
Ein einzelnes Molekül hat die chemischen Eigenschaften eines Stoffes. Die physikalischen Eigenschaften, wie Siede- oder Schmelzpunkteines molekularen Stoffes werden durch zwischenmolekulare Kräfte bestimmt und können bei Feststoffen zur Bildung von Molekülgittern führen. Große Moleküle werden Makromoleküle genannt. Aus Makromolekülen bestehen Kunststoffe wie Polyethylenterephthalat(PET) und Biopolymere wie die Stärke.
Die Größe von zweiatomigen Molekülen liegt im Bereich von 10-10 m (1 Å) [Ångström] , relativ große Moleküle aus recht vielen Atomen erreichen einen Durchmesser im Bereich von 10-9 m (10 Å), wobei Makromoleküle noch etwas größer sein können. Experimentell lässt sich die Größe von Molekülen z.B. mit dem Ölfleckversuch abschätzen.
Die Bindungsverhältnisse in Molekülen werden beispielsweise mit dem VSEPR-Modell oder der Molekülorbitaltheorie erklärt und beschrieben.
Abgrenzung
Nicht alle chemischen Verbindungenbestehen aus individuellen Molekülen. Keine Moleküle liegen z.B. bei diamantartigen Stoffen, wie Borcarbid (B4C) und Siliciumcarbid (SiC) vor. Die Atome werden zwar durch kovalente Bindungen zusammengehalten, ein typisches Molekül lässt sich jedoch nicht festlegen. Die chemische Formel ist nur eine Verhältnisformel. Die Anordnung der Atome lässt sich durch eine Elementarzelle darstellen, welche sich immer wiedererholt und mit formal offenen (ungenutzten) Valenzelektronen an ihrer Oberfläche enden.
Keine Moleküle liegen bei Salzen wie Natriumchlorid(NaCl) vor, die durch ionische Bindungen zusammengehalten werden. Auch hier gibt die Formel das Verhältnis der beteiligten Atome wieder und auch hier kann der Verband der Atome prinzipiell eine beliebige Größe haben und den Bereich von einigen Millimetern erreichen. Grundelemente dieses Verbindungstyps sind Teilchen (hier Atome) mit einer Ladung. Solche Teilchen werden allgemein Ionen genannt. Das Natriumatom bildet ein Kation (Na+), Chloratom ein Anion (Cl-). Im Fall von Natriumsulfat (Na2SO4) besteht das Anion SO42- aus einem Atomverband, der eine Ladung trägt. Atomverbände mit Ladungen werden im engen Sinn nicht Moleküle genannt. Dies ist auch in der organischen Chemie üblich: Essigsäure besteht aus Molekülen, das Anion der Säure wird Acetat-Ion genannt. Ein Sonderfall ist die Massenspektrometrie, bei der der Begriff Molekül-Ion verwendet wird.
Im engen Sinn werden mehratomige Radikale nicht Moleküle genannt, da diese Teilchen chemisch nicht abgesättigt sind. Es ist genügend und eindeutig, sie Radikale zu nennen. Besonders in der organischen Chemie sind sie hochreaktive Zwischenprodukte in bestimmten chemischen Reaktionen. Es gibt jedoch auch stabile Radikale, wie Stickstoffmonoxid oder 2,2,6,6-Tetramethylpiperidinyloxyl (TEMPO). Hier führen zwischenmolekulare Kräfte zu physikalischen Eigenschaften der Verbindungen und diese Verbindungen können als molekular betrachtet werden.
Darstellungsweisen
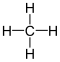
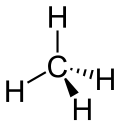
Es gibt verschiedene Möglichkeiten, Moleküle darzustellen. Grundsätzlich kann dabei zwischen Formelschreibweisen, zweidimensionalen Schemata (sog. Strukturfomeln) und dreidimensionalen Modellen (sog. Stereoformeln) unterschieden werden. Summenformeln haben den niedrigsten, Stereoformeln den höchsten Informationsgehalt. Um von abstrahierten Schreibweisen auf die tatsächliche Anordnung schliessen zu können, sollte man sich bewusst sein, dass die kovalenten Bindungen ungefähr in Form eines Tetraeders angeordnet sind. (siehe Kovalente Bindungen; Räumliche Ausrichtung)
| Strukturformeln | Andere Darstellungsweisen | ||||||
|---|---|---|---|---|---|---|---|
| Elektronenformel | Valenzstrichformel | Keilstrichformel | Skelettformel | Konstitutionsformel | Summenformel | Verhältnisformel | |
| Methan | 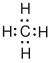 |
 |
 |
existiert nicht | CH4 | CH4 | CH4 |
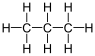
| Propan | 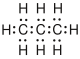 |
 |
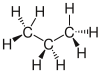 |
CH3–CH2–CH3 | C3H8 | C3H8 | |
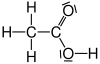
| Essigsäure | 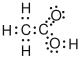 |
 |
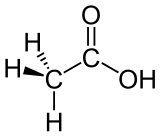 |
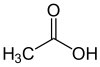 |
CH3–COOH | C2H4O2 | CH2O |
| Wasser | existiert nicht | existiert nicht | H2O | H2O | |||
Gebräuchliche räumliche Molekülmodelle sind das Kalottenmodell und Stäbchenmodell.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 28.05. 2024