Methan
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| MAK | Schweiz: 10000 ml/m3 oder 6700 mg/m3[3] | |||||||
| Treibhauspotential | 28 (bezogen auf 100 Jahre) | |||||||
Methan ist eine chemische Verbindung aus der Gruppe der Kohlenwasserstoffe und das einfachste Alkan. Das farb- und geruchlose, brennbare Gas kommt in der Natur vor und ist als Hauptbestandteil von Erdgas und in der chemischen Industrie als Heizgas und Ausgangsprodukt für technische Synthesen von großer Bedeutung.
| Strukturformel | ||
|---|---|---|
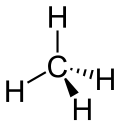 |
||
| Keile zur Verdeutlichung der räumlichen Struktur | ||
| Allgemeines | ||
| Name | Methan | |
| Andere Namen |
| |
| Summenformel | CH4 | |
| CAS-Nummer | ||
| EG-Nummer | 200-812-7 | |
| ECHA-InfoCard | ||
| PubChem | ||
| DrugBank | ||
| Kurzbeschreibung | farb- und geruchsloses Gas | |
| Eigenschaften | ||
| Molare Masse | 16,04 g·mol-1 | |
| Aggregatzustand | gasförmig | |
| Dichte |
| |
| Schmelzpunkt | -182°C | |
| Siedepunkt | -162 °C | |
| Löslichkeit |
| |
| Thermodynamische Eigenschaften | ||
| ΔHf0 | −74,6 kJ/mol (Gas) | |
Eigenschaften
Physikalische Eigenschaften
Methan schmilzt bei -182,6°C und siedet bei -161,7°C. Aufgrund der unpolaren Eigenschaften ist es in Wasser kaum löslich, in Ethanol und Diethylether löst es sich jedoch gut. Schmelzwärme und Verdampfungswärme sind mit 1,1 kJ/mol und 8,17 kJ/mol für ein Gas relativ hoch, im Vergleich zu Metallen sind dies aber sehr geringe Werte. Der Heizwert Hi liegt bei 35,89 MJ·m-3. Die Standardentropie beträgt 188 J·mol-1·K-1, die Wärmekapazität 35,69 J·mol-1·K-1. Bei 90,67K und 0,117 bar weist Methan einen Tripelpunkt auf, bei 190,56 K und 45,96 bar einen kritischen Punkt.
Das farb- und geruchlose Gas hat eine geringere Dichte als Luft, es steigt also in die höheren Schichten der Erdatmosphäre auf. Dort wirkt es als Treibhausgas, wobei es 20- bis 30-mal wirkungsvoller ist als Kohlenstoffdioxid, allerdings kommt es in viel geringeren Mengen als dieses in der Atmosphäre vor. Es reagiert dort mit Sauerstoff zu Kohlenstoffdioxid und Wasser. Dieser Prozess ist allerdings langsam, die Halbwertszeit wird auf 14 Jahre geschätzt.
Chemische Eigenschaften
Methan ist das einfachste Alkan und der einfachste Kohlenwasserstoff, die Summenformel lautet CH4, die C-H-Bindungen weisen in die Ecken eines Tetraeders. Es ist brennbar und verbrennt an der Luft mit bläulicher, nicht rußender Flamme. Es kann explosionsartig mit Sauerstoff oder Chlor reagieren, wozu allerdings eine Initialzündung (Zufuhr von Aktivierungsenergie) oder Katalyse erforderlich ist. Bei der Chlorierung entstehen Chlormethan, Dichlormethan, Chloroform und Tetrachlormethan. Bei der Oxidation dagegen wird das Molekül komplett auseinandergerissen. Aus der Reaktion eines Methanmoleküls mit zwei Sauerstoffmolekülen entstehen zwei Wasser- und ein Kohlenstoffdioxidmolekül. Vom Methan leiten sich Methylverbindungen wie z. B. Methanol und die Methylhalogenide sowie die längerkettigen Alkane ab.
Vorkommen und Entstehung
| Planet | Anteil |
|---|---|
| Erde | 1,75 ppm |
| Mars | 10,5 ppb |
| Jupiter | 3000 ± 1000 ppm |
| Saturn | 4500 ± 2000 ppm |
| Neptun | 1,5% ± 0,5% |
Methan kommt vielfältig vor und wird auf der Erde ständig neu gebildet, so z.B. bei biologischen und geologischen Prozessen. Auf der Erde werden schätzungsweise jährlich 600 Millionen Tonnen Methan emittiert. Auch auf vielen anderen Planeten gibt es Methanvorkommen.
Auf der Erde entsteht Methan oberflächennah auf biogenem Weg (Methanogenese) durch mikrobielle Fermentation und CO2-Reduktion. Auf abiogenem Weg kann es thermal im Rahmen des Reifeprozesses von Kohle (geochemische Phase der Inkohlung), sowie aus allen Typen von Kerogenen und Erdöl entstehen.
Methan entsteht im tieferen Untergrund unterhalb der Oberfläche der Erde bei hohen Temperaturen und Drücken und wird meist bei vulkanischen Aktivitäten frei. Es ist Hauptbestandteil des Erdgases (85-98%), das vor allem als Begleiter von Erdöl vorkommt. Auch das in Steinkohlelagern eingeschlossene Grubengas enthält hauptsächlich Methan.
Methan, das am Meeresgrund austritt, wird durch den hohen Druck und die tiefe Temperatur zu festem Methanhydrat, auch als "Methaneis" bezeichnet, umgewandelt. Der Kohlenstoffgehalt in den weltweiten Methanhydratvorkommen wird auf 500-3000 Gt geschätzt. Zum Vergleich: Der Kohlenstoffgehalt der nachgewiesenen Kohlereserven beträgt etwa 900 Gt. Eine Gewinnung des Methanhydrats könnte zur Lösung des Energieproblemes beitragen, ist jedoch problematisch. Ein besonderes Problem besteht zum Beispiel darin, dass bei der Bergung viel Methan in die Erdatmosphäre gelangen würde und dort als starkes Treibhausgas zu einer weiteren Erwärmung und damit weiterer Freisetzung von Methan beitragen würde. Außerdem ist die Förderung von Methanhydrat nicht ungefährlich. Erste Förderungsversuche sind bereits im Gange. Die Folgen eines Raubbaus sind weitgehend ungeklärt - Forscher befürchten das Abrutschen der Kontinentalabhänge, welche zu großen Teilen aus Methaneis (welches durch die Förderung instabil werden könnte) bestehen. Wegen der Klimaerwärmung und der damit verbundenen Meerwassererwärmung befürchten einige Forscher das Schmelzen und Verdampfen des Methanhydrats. Dies würde zusätzlich Methan als Treibhausgas in die Erdatmosphäre bringen und den anthropogenen Treibhauseffekt verstärken.
Ein großer Teil des Methans wird durch Mikroorganismen gebildet: Beim Faulen organischer Stoffe unter Luftabschluss in Sümpfen oder am Grund stark verschmutzter Gewässer bildet sich Sumpfgas, ein Gemisch aus Methan und Kohlenstoffdioxid. Auch Biogas besteht überwiegend aus Methan (etwa 60%) und Kohlenstoffdioxid (etwa 35%), daneben enthält es noch Wasserstoff, Stickstoff und Schwefelwasserstoff.
Die biologische Bildung von Methan wird durch spezielle Vertreter der Archaeen, den Methanogenen, verursacht. Sie nutzen einfache organische Verbindungen wie Kohlenstoffdioxid oder Methanol und reduzieren diese zu Methan, um Energie zu gewinnen. Dieser Prozess wird Methanogenese genannt. Beispielsweise werden bei der Bildung von Methan aus CO2 und Wasserstoff (H2) unter Standardbedingungen bei einem pH-Wert von 7 etwa 131 kJ/mol an Freier Energie (Gibbs-Energie, ΔG0-) freigesetzt

- Aus Kohlenstoffdioxid und Wasserstoff wird Methan und Wasser
Etwa 70% der mikrobiellen Methanemission der Erde ist auf Aktivitäten der Menschen zurückzuführen. Durch landwirtschaftlichen Anbau und Tierhaltung wird Methan emittiert, 39% dieser Emissionen gehen auf die Rinderhaltung zurück, 17% auf den Nassreisanbau. In Deutschland wurden 1994 etwa 833.000 Tonnen Methan emittiert.
Die Methan-Konzentration in der Atmosphäre hat sich vom Jahr 1750 bis zum Jahr 2000 von 0,8 auf 1,75 ppm erhöht (also mehr als verdoppelt: + 119%).
In der Atmosphäre des Mars wurde Methan nachgewiesen, allerdings nur etwa 10,5 ppb. Da es sich normalerweise nicht in der Atmosphäre halten kann und es keine Hinweise auf Meteoriten als Quelle gibt, muss es auf dem Mars neu gebildet worden sein, was ein Indiz für Leben sein kann. Allerdings könnte das Methan auch vulkanischen Ursprungs sein, wofür auf dem Mars noch keine Hinweise gefunden wurden; 2008 wurde jedoch nachgewiesen, dass das Methan aus den Lost-City-Hydrothermalquellen geochemischen Ursprungs ist. Auch in den Atmosphären von Titan, Jupiter, Saturn, Uranus, Neptun und Pluto gibt es Methan. Außerhalb unseres Sonnensystems ist Methan als erstes organisches Molekül auf Planeten nachgewiesen worden. Im Weltall ist Methan also in größeren Mengen auf Planeten, Kometen sowie Monden vorhanden.
Historische Informationen
Das Wort Methan stammt vermutlich aus dem Altgriechischen. Die Griechen wussten wohl schon in der Antike von dem entzündlichen Gas. So gab es in Kleinasien Orte, an denen sich Methangas-Quellen entzündeten. Ein Vulkangebiet, in dem solche Gase vorkamen, bekam nach diesem Gas auch den Namen Methana.
Methan war schon den Alchemisten im Mittelalter als Bestandteil von Fäulnisgasen, auch als Sumpfluft bezeichnet, bekannt.
Methan wurde 1667 von Thomas Shirley entdeckt. 1772 entdeckte Joseph Priestley, dass Methan bei Fäulnisprozessen entsteht. 1856 stellte Marcellin Berthelot Methan zum ersten Mal aus Kohlenstoffdisulfid und Schwefelwasserstoff her.
In älteren Texten wurde Methan gelegentlich auch als Methylwasserstoff bezeichnet.
Herstellung
Für die Herstellung aus Aluminiumcarbid gibt es zwei Methoden, sie werden allerdings meist nur im Labor eingesetzt. Die Synthese aus Kohlenstoffmonoxid hat eine besondere Wichtigkeit, da das giftige Kohlenstoffmonoxid, das eigentlich unerwünscht/unbrauchbar ist, sinnvoll genutzt werden kann, lediglich die Quelle des Wasserstoffs stellt bei dieser Synthese ein Problem dar.

- Aluminiumcarbid reagiert mit Wasserzu Aluminiumhydroxid und Methan, wenn es erhitzt wird.

- Aluminiumcarbid reagiert mit Salzsäure zu Aluminiumchlorid und Methan.

- Kohlenstoffdioxid
reagiert mit Wasserstoff
zu Methan und Wasser.
Diese Reaktion wurde im 19. Jahrhundert vom Franzosen und Nobelpreisträger Paul Sabatier entdeckt und wird deshalb Sabatier-Prozess genannt.
- Kohlenstoffdioxid
reagiert mit Wasserstoff
zu Methan und Wasser.
Heute wird auch viel Methan als Brennstoff in Biogasanlagen hergestellt. Auch durch Holzvergasung kann Methan gewonnen werden. Die Methanisierung nach vorhergehender Wasserelektrolyse ist das Grundprinzip zur Gewinnung von Wind- oder Solargas, dem im Bereich der regenerativen Energien eine zunehmende Bedeutung zugeschrieben wird.
Umgang, Gefahren und Sicherheit
Mit einem Volumenanteil zwischen 4,4 und 16,5 Prozent in der Luft bildet es explosive Gemische bzw. gefährliche explosionsfähige Atmosphären (geA). Durch unbemerktes Ausströmen von Erdgas kommt es immer wieder zu folgenschweren Gasexplosionen. Auch die gefürchteten Grubengasexplosionen in Kohlebergwerken (Schlagwetter) sind auf Methan-Luft-Gemische zurückzuführen. Methan ist hoch entzündlich, der Flammpunkt liegt bei -188°C, die Zündtemperatur bei 600°C. Methanbehälter sollen an gut belüfteten Orten aufbewahrt werden, es sollte von Zündquellen ferngehalten werden und es sollten Maßnahmen gegen elektrostatische Aufladung getroffen werden. Methan wird unter hohen Drücken und meist bei tiefen Temperaturen (um die Dichte zu erhöhen) aufbewahrt, in Gasflaschen bei 150 bar, in Tankerschiffen bei etwa -160°C.
Methan wird bei tiefen Temperaturen flüssig gelagert, weil die Dichte dadurch enorm erhöht werden kann. Aus diesem Grund kann es beim Austritt dieses gekühlten Methans leicht zu Erfrierungen kommen. Methan ist ungiftig, die Aufnahme von Methan kann allerdings zu erhöhten Atem- (Hyperventilation) und Herzfrequenzen führen, es kann kurzzeitig zu niedrigem Blutdruck, Taubheit in den Extremitäten, Schläfrigkeit, mentaler Verwirrung und Gedächtnisverlust, alles hervorgerufen durch Sauerstoffmangel, führen. Methan führt aber nicht zu bleibenden Schäden. Wenn die Symptome auftreten, sollte das betroffene Areal verlassen und tief eingeatmet werden, falls daraufhin die Symptome nicht verschwinden, sollte die betroffene Person in ein Krankenhaus gebracht werden.
Verwendung
Methan wird vorwiegend als Heizgas zur Wärmeerzeugung und zum Betrieb von Motoren durch Verbrennung genutzt. Neben Methan aus anderen Quellen wird zu diesem Zweck Biogas mit einem Methangehalt von etwa 50 bis > 70% aus Mist, Gülle, Klärschlamm oder organischem Müll gewonnen. Früher wurde Methan durch Pyrolyse von Holz gewonnen (Holzvergasung). Holzgas diente im und nach dem Zweiten Weltkrieg zum Betrieb von Automobilen.
Methan ist ein wichtiges Ausgangsprodukt für technische Synthesen von Wasserstoff, Methanol, Ethin, Blausäure, Schwefelkohlenstoff und Methylhalogeniden. Es dient als Ausgangspunkt für viele andere organische Verbindungen.
Reaktionen
Reaktionen mit Sauerstoff
Mit Sauerstoffgeht Methan unterschiedliche Reaktionen ein, je nachdem wie viel Sauerstoff für die Reaktion zur Verfügung steht. Nur bei genügend großem Sauerstoffangebot ist eine vollständige Verbrennung des Methans mit optimaler Energieausbeute möglich.
Bei ungenügender Sauerstoffzufuhr hingegen entstehen unerwünschte Nebenprodukte wie Kohlenstoffmonoxid (CO) und Kohlenstoff(Ruß). Ferner ist in diesem Fall die Nutzenergie geringer.
Weitere Reaktionen
Methan geht außer mit Sauerstoff noch vielfältige weitere Reaktionen ein. Viele davon sind sehr wichtig für die chemische Industrie, da die Entstehungsprodukte von großer technischer Bedeutung sind.

- Methan reagiert mit Schwefel bei 700°C und unter Aluminiumoxid-katalysator zu Kohlenstoffdisulfid und Schwefelwasserstoff.

- Methan reagiert mit Ammoniak und Sauerstoff an einem Platinkatalysator zu Blausäure und Wasser.

- Methan reagiert photochemisch (lichtinduziert) mit Halogenen zu Methylhalogeniden und Halogenwasserstoffen, hier zum Beispiel mit Chlor.
Biologie, Geologie und Klimatologie

Methan ist ein hochwirksames Treibhausgas. Allerdings nur chemisch, durch seinen verschwindend geringen Anteil in der Atmosphäre von 1,75 ppm bei einen angenommenen Treibhauspotenzial von 25 bis zum 33 fachen von Kohlendioxid, entspricht die Treibhauswirkung rechnerisch maximal 57,75 ppm Kohlendioxid bzw. 0,005% CO2 in der Atmosphäre. Durch die zudem durchschnittliche Verweilbarkeit von nur 12 Jahren vor dem Zerfall wieder zu CO2 und H2O, ist es daher faktisch nicht möglich eine nennenswerte Treibhauswirkung mit Methan zu erzielen.
Das Treibhauspotenzial von 1 kg Methan ist, auf einen Zeitraum von 100 Jahren betrachtet, 25 mal höher als das von 1 kg Kohlenstoffdioxid. Nach einer neueren Untersuchung beträgt dieser Faktor sogar 33, wenn Wechselwirkungen mit atmosphärischen Aerosolen berücksichtigt werden.
Die zunehmende Haltung von Rindern, der häufige Nassreisanbau
und Emissionen
von Deponiegas führen zu einer
Verstärkung des Treibhauseffektes.
Die archaeellen Methanbildner sind für die
ständige Neubildung von Methan hauptverantwortlich. Ein Hausrind stößt täglich etwa
150-250l Methan aus, weil im Rindermagen archaeelle Methanbildner an der
Zersetzung von Zellulose
beteiligt sind. [In diese Kategorie gehört auch der Mensch.]
Neue Erkenntnisse zeigen, dass Pflanzen ständig Methan
produzieren und so schon immer zum Methan-Gehalt der Atmosphäre beitragen.
Die FAO schreibt dem Viehwirtschaftssektor ein knappes Fünftel der anthropogenen
bzw. vom Menschen verursachten Treibhausgasemissionen zu, etwas mehr als dem
Transportsektor.
Inwiefern Knoblauchextrakte im Futter zu geringeren Ausstößen führen können,
wird untersucht.
Methan wird durch bestimmte Bakterien in Gewässern und Böden mit Sauerstoff (O2) zu Kohlenstoffdioxid und Wasser oxidiert. Diese Umsetzung ist exergon und die Bakterien nutzen sie als Energiequelle.
Man nimmt an, dass Methan neben Ammoniak und Wasserdampf als ein Hauptbestandteil einer Uratmosphäre vorkam.
In einer sauerstoffhaltigen Atmosphäre wird Methan langsam, insbesondere durch Hydroxyl-Radikale, oxidiert. Ein einmal in die Atmosphäre gelangtes Methan-Molekül hat dort eine durchschnittliche Verweilzeit von zwölf Jahren.
Methan außerhalb der Erde

Auf dem Saturnmond Titan herrscht bei -180°C und ca. 1,6 Bar Atmosphärendruck fast der Tripelpunkt des Methans. Methan kann deshalb auf diesem Mond in allen drei Aggregatzuständen auftreten. Es gibt Wolken aus Methan, aus denen Methan regnet, das dann durch Flüsse in Methanseen fließt, dort wieder verdunstet und so einen geschlossenen Methankreislauf bildet (analog zum Wasserkreislauf auf der Erde).
Für den Ontario Lacus, einen See nahe dem Südpol des Titan, wurde jedoch als Hauptbestandteil das schwerere Ethan nachgewiesen.
Im März 2008 wurde Methangas erstmals auch auf einem Planeten außerhalb unseres Sonnensystems gefunden (Exoplanet HD 189733b vom Typ der Hot Jupiters).
2009 wurde über Methaneruptionen auf dem Mars berichtet (Michael J. Mumma et al.: Strong Release of Methane on Mars in Northern Summer 2003, Science January 15, 2009).
Einzelnachweise
- ↑ Eintrag zu
 CAS-Nr. 74-82-8 in der GESTIS-Stoffdatenbank
des IFA.
CAS-Nr. 74-82-8 in der GESTIS-Stoffdatenbank
des IFA.
- ↑ Eintrag zu
 Methane im Classification and Labelling
Inventory der Europäischen Chemikalienagentur (ECHA).
Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
erweitern.
Methane im Classification and Labelling
Inventory der Europäischen Chemikalienagentur (ECHA).
Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva):
 Grenzwerte – Aktuelle MAK- und
BAT-Werte (Suche nach 74-82-8 bzw. Methan).
Grenzwerte – Aktuelle MAK- und
BAT-Werte (Suche nach 74-82-8 bzw. Methan).

Basierend auf einem Artikel in ![]() Wikipedia.de
Wikipedia.de

© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 24.04. 2022




