Chloroform
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| MAK | DFG/Schweiz: 0,5 ml/m3 bzw. 2,5 mg/m3[1][5] | |||||||
| Treibhauspotential | 20 (bezogen auf 100 Jahre)[6] | |||||||
Chloroform (systematische Bezeichnung Trichlormethan) ist ein chlorierter Kohlenwasserstoff mit der Summenformel CHCl3. Formal ist es das Trichlorid der Orthoameisensäure, woraus sich der Name herleitet.
| Strukturformel | ||
|---|---|---|
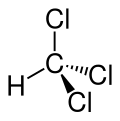
| ||
| Keilstrichformel zur Verdeutlichung der Geometrie | ||
| Allgemeines | ||
| Name | Chloroform | |
| Andere Namen | ||
| Summenformel | CHCl3 | |
| Kurzbeschreibung | farblose Flüssigkeit mit süßlichem Geruch[1] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 200-663-8 | |
| ECHA-InfoCard | ||
| PubChem | ||
| DrugBank | ||
| Eigenschaften | ||
| Molare Masse | 119,38 g/mol | |
| Aggregatzustand | flüssig | |
| Dichte | 1,48 g/cm3 (20 °C)[1] | |
| Schmelzpunkt | −63 °C[1] | |
| Siedepunkt | 61 °C[1] | |
| Dampfdruck | ||
| Löslichkeit | schlecht in Wasser (8 g/l bei 20 °C)[1] | |
| Dipolmoment | 1,04(2) D[2] (3,5 · 10−30 C · m) | |
| Brechungsindex | 1,445 (nD20)[3] | |
| Thermodynamische Eigenschaften | ||
| ΔHf0 | −134,1 kJ/mol[7] | |
In der Industrie dient es als Lösungsmittel und zur Herstellung von Fluorchlorkohlenwasserstoffen. Seit der Mitte des 19. Jahrhunderts war Chloroform eines der ersten in der Medizin verbreitet eingesetzten Narkosemittel. Als solches wird es aber wegen seiner Toxizität seit dem Anfang des 20. Jahrhunderts nicht mehr eingesetzt.
Geschichte
Entdeckung
Chloroform wurde erstmals 1831 unabhängig voneinander von dem US-Amerikaner Samuel Guthrie,[8] dem Deutschen Justus Liebig[9] in Gießen und dem Franzosen Eugène Soubeiran in Paris hergestellt. Seine physikalischen und chemischen Eigenschaften sowie eine Summenformel („C4H2Cl6“[10] bzw. C2H2Cl6[11]) beschrieb erstmals Jean-Baptiste Dumas 1834. Dumas gab der von Liebig noch als „Chlorkohlenstoff“ bezeichneten Substanz auch den Namen „Chloroform“.[12]
Einsatz als Narkosemittel
-3.jpg)
Die narkotisierende Wirkung von Chloroform wurde im Tierversuch schon 1842 von dem britischen Arzt Robert Mortimer Glover und 1847 von dem französischen Physiologen Marie Jean Pierre Flourens sowie dem schottischen Arzt und Geburtshelfer James Young Simpson[13][14] erkannt. Es war das Verdienst des Letzteren, Chloroform ein Jahr darauf neben dem schon seit Ende 1846 gebräuchlichen Äther in die ärztliche Praxis zur Ausschaltung oder Linderung von Geburtsschmerzen einzuführen.
Einen ersten Vorschlag zur praktischen Anwendung der Chloroformnarkose zur chirurgischen Anästhesie hatte zuvor wohl schon Simpsons Freund, der Chirurg und Chemiker David Waldie[15] (* 1813 in Linlithgow)[16] gemacht. Auch der Erlanger Mediziner Johann Ferdinand Heyfelder stellte ab 1847 neben klinischen Versuchen mit Äther auch solche mit Chloroform an und plädierte 1848 für dessen bevorzugte Anwendung[17] als Narkosemittel.
Aufgrund der schneller und für den Patienten angenehmer einsetzenden Wirkung, der tieferen Narkose, der geringeren Reizung der Bronchien und des seltener auftretenden postoperativen Erbrechens verdrängte Chloroform zunächst weitgehend den Äther als Narkosemittel.[18] Der erste dokumentierte Anästhesietodesfall war eine 1848 durchgeführte Chloroformnarkose bei der Patientin Hanna Greener.[19] Einer der Pioniere der Äthernarkose, Horace Wells, hatte sich im Januar 1848, bevor er sich bei seinem Suizid die Pulsadern öffnete, mit Chloroform betäubt.[20]
Nachdem John Snow 1853 das Chloroform auch erfolgreich bei der Königin Victoria (Oberhaupt der englischen Staatskirche) zur „Anaesthesie à la reine“[21][22] angewendet hatte, wurde es in Europa zunächst das am meisten verbreitete Narkosemittel. Auch Joseph T. Clover (1825–1882), ab 1858 „Chloroformist“ in London, verwendete für seinen, ein Luft-Lachgas-Gemisch zuführenden Narkoseapparat auch Chloroform und Äther.[23] John Snow (England, 1858) und Friedrich Trendelenburg (Deutschland, 1871) verwendeten bei Narkosen ein Chloroform-Luft-Gemisch zur Verabreichung über ein Tracheostoma, William Macewen (Schottland, 1880) und E. Schlechtendahl (Deutschland, 1902) über einen oral eingeführten Endotrachealtubus.[24][25] Im Jahr 1874 hatte T. G. Hake im Practitioner Forschungsergebnisse von Moritz Schiff veröffentlicht, die zeigten, dass Versuchstiere, die nach hohen Dosen von Äther bzw. Chloroform einen Herzstillstand erlitten, im Falle von Äther durch künstliche Beatmung wiederbelebt werden konnten, im Falle von Chloroform aber zusätzlich eine direkte Herzmassage dazu benötigten (Schiff selbst veröffentlichte seine Ergebnisse erst 22 Jahre später schriftlich).[26]
Ab etwa 1890 wurde, wegen der unerwünschten Nebenwirkungen mit häufigen anästhesiebedingten Todesfällen[27][28] bei Chloroformnarkosen, jedoch (zunächst in den USA) wieder die Ätheranwendung bevorzugt[29] und ab 1900 löste der Äther in weitem Umfang Chloroform als Narkosemittel ab.[30] Eine tiefe Chloroformnarkose beschrieb E. Schlechtendahl in Barmen jedoch 1902 zur Betäubung vor der oralen Intubation.[31] Durch Bernhard Kroenig erfolgte um 1903 eine technische Verbesserung der Äther- und Chloroformnarkose mit dem Roth-Draegerschen Mischapparat.[32][33] Krakow und andere kombinierten Chloroform auch mit anderen Narkosemitteln, etwa mit Hedonal.[34]
Die geburtshilfliche Schmerzlinderung mit Chloroform geschah gegen den Widerstand der anglikanischen Kirche. Viele Kleriker hielten Qualen der Geburt für die gerechte Strafe für Evas Sündenfall, also für gottgewollt.[35][36] Dem setzte James Young Simpson, 1847 der Begründer der geburtshilflichen Anästhesie mit Äther bzw. Chloroform in einer 1849 von ihm veröffentlichten Schrift entgegen, dass bei der Erschaffung Evas ebenfalls eine „Anästhesie“ durchgeführt worden sei.[37]
Eine intravenöse Gabe des Chloroforms zur Erzielung einer Narkose, wie sie von dem Würzburger Chirurgen Ludwig Burkhardt 1909 vorgestellt[38] wurde, hat sich nach schweren Komplikationen nicht durchsetzen können.[39]
Aus England kam 1957 das erste klinisch brauchbare halogenierte Inhalationsnarkotikum nach dem Chloroform, nämlich Halothan.[40]
Herstellung
Industriell wird Chloroform durch Erhitzen von Chlor mit Methan oder Chlormethan auf 400–500 °C erzeugt. Bei dieser Temperatur wird schrittweise radikalisch substituiert bis hin zum Tetrachlormethan:
Dabei reagiert Methan mit Chlor unter Bildung von Chlorwasserstoff zunächst zu Chlormethan, dann weiter zu Dichlormethan, Trichlormethan und schließlich zu Tetrachlormethan. Das Ergebnis des Prozesses ist eine Mischung der vier Chlormethane, welche durch Destillation getrennt werden können. Industriell hergestelltes Chloroform technischer Reinheit enthält zudem Brom- und Ethanderivate (z. B. Bromchlormethan, Bromdichlormethan, 1,2-Dichlorethan) als Verunreinigung[41] sowie Ethanol (< 1 %) oder Pentene (< 0,1 %), die als Stabilisator künstlich zugefügt werden, um das beim Lagern an Luft und Licht entstehende Phosgen abzufangen.[42]
Alternativ kann Chloroform durch Photochlorierung von Methan erhalten werden. Im Labor kann Chloroform durch die Reaktion von Natriumhypochlorit mit Aceton, eine Haloform-Reaktion, dargestellt werden.[43]
Eigenschaften
Physikalische Eigenschaften
Trichlormethan ist eine farblose, nicht entflammbare, flüchtige Flüssigkeit von süßlichem Geruch. Der Schmelzpunkt liegt bei −63 °C, der Siedepunkt unter Normaldruck bei 61 °C. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,20772, B = 1233,129 und C = −40,953 im Temperaturbereich von 215 bis 334 K und mit A = 4,56992, B = 1486,455 und C = −8,612 im Temperaturbereich von 334,4 bis 527 K.[44] Es hat eine größere Dichte als Wasser und ist nur wenig darin löslich. Die Mischbarkeit mit Wasser ist begrenzt. Mit steigender Temperatur sinkt die Löslichkeit von Chloroform in Wasser bzw. steigt die Löslichkeit von Wasser in Chloroform.[45]
Löslichkeiten zwischen Chloroform und Wasser[45] Temperatur (in °C) 0 9,5 19,6 29,5 39,3 49,2 59,2 Chloroform in Wasser (Massenanteil in %) 1,02 0,93 0,82 0,79 0,74 0,77 0,79 Wasser in Chloroform (Massenanteil in %) 0,0365 0,0527 0,0661 0,0841 0,1108 0,1353 0,1672
Die Verbindung bildet mit einer Reihe von Lösungsmitteln azeotrop siedende Gemische. Die azeotropen Zusammensetzungen und Siedepunkte finden sich in der folgenden Tabelle. Keine Azeotrope werden mit n-Pentan, n-Heptan, Cyclohexan, Benzol, Toluol, n-Propanol, i-Butanol, Tetrachlorkohlenstoff, Diethylether, 1,4-Dioxan, n-Butylacetat, Essigsäure, Acetonitril, Nitrobenzol, Schwefelkohlenstoff und Pyridin gebildet.[46]
| Azeotrope mit verschiedenen Lösungsmitteln[46] | ||||||||||||
| Lösungsmittel | Wasser | Methanol | Ethanol | 2-Propanol | Aceton | 2-Butanon | ||||||
| Gehalt Chloroform | in w% | 97 | 87 | 93 | 96 | 78 | 17 | |||||
| Siedepunkt | in °C | 56 | 53 | 59 | 61 | 64 | 80 | |||||
| Lösungsmittel | Diisopropylether | Tetrahydrofuran | Methylacetat | Ethylacetat | n-Hexan | |||||||
| Gehalt Chloroform | in w% | 36 | 66 | 77 | 28 | 83 | ||||||
| Siedepunkt | in °C | 71 | 73 | 65 | 78 | 60 | ||||||
Chemische Eigenschaften
Chloroform wird durch Sauerstoff unter Lichteinfluss photochemisch zersetzt, dabei entstehen Phosgen, Chlor und Chlorwasserstoff. Die Zersetzung kann jedoch auch durch Gammastrahlen sowie Ultraschall in Form einer Kettenreaktion in Gang gebracht werden.[47] Handelsübliches Chloroform enthält 0,5–1,0 % Ethanol als Stabilisator, um entstehendes Phosgen chemisch abzufangen.
Seine Struktur (CHX3) bildet eine homologe Reihe mit Fluoroform, Bromoform und Iodoform.
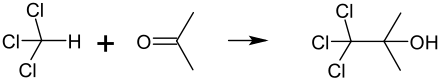
Reaktion mit Aceton
Aceton und (das ähnlich riechende) Chloroform dürfen nicht in höheren Konzentrationen gemischt werden, weil es in Gegenwart von Spuren basisch reagierender Stoffe zu einer sehr heftigen Reaktion kommen kann, bei der 1,1,1-Trichlor-2-methyl-2-propanol (α,α,α‐Trichlor‐tert‐butanol) entsteht. Auch aus diesem Grund sollen im Labor chlorierte und nicht chlorierte Lösemittelabfälle getrennt gesammelt werden.[48]
Verwendung
Chloroform wird in erster Linie als Lösungsmittel und zur Herstellung von Fluorchlorkohlenwasserstoffen (FCKW) verwendet.
Mit alkoholischem Kali und Ammoniak entsteht beim Erhitzen Kaliumcyanid.[49] Bei Verwendung primärer Amine statt Ammoniak erhält man Isonitrile. Mit dieser von August Wilhelm von Hofmann entdeckten Reaktion lassen sich primäre Amine auch qualitativ nachweisen, denn die Isonitrile geben sich durch einen starken und üblen Geruch zu erkennen.[50]
In der chemischen Synthese wird es zur Herstellung von Dichlorcarben (in Gegenwart von Basen) verwendet. Durch Friedel-Crafts-Alkylierung mit Benzol erhält man Triphenylmethan.
Bei der Bestimmung der mikrobiellen Biomasse in Bodenproben mittels Chloroform-Fumigation-Extraktion wird ausgenutzt, dass Chloroform Zelllyse verursacht.
Chloroform wird zur Bestimmung der Iodzahl nach Hanuš benutzt, und zur Bestimmung der Peroxidzahl nach Wheeler als Eisessig-Chloroform-Gemisch.
Sicherheitshinweise
Die Dämpfe von Chloroform verursachen Bewusstlosigkeit und senken die Schmerzempfindung. Bereits Anfang 1848 gab es den ersten Bericht über eine tödlich verlaufene Narkoseeinleitung mit Chloroform. Im Jahr 1850[51] waren mindestens elf Chloroformtodesfälle bekannt.[52] Wegen der toxischen Wirkung auf Herz, Leber und andere innere Organe wird Chloroform seit Anfang des 20. Jahrhunderts[53][54] kaum noch und heute nicht mehr als Narkosemittel angewendet. Es steht außerdem unter Verdacht, krebserregend zu sein.
Rechtsbestimmungen
Die Anwendung von Chloroform ist bei Lebensmittel liefernden Tieren gemäß der EU-Rückstandshöchstmengen-Verordnung für Lebensmittel tierischen Ursprungs in der Europäischen Union generell verboten.
Deuterochloroform
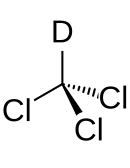
Deuteriertes Chloroform[55] (Summenformel:
CDCl3, CAS-Nr.: ![]() 865-49-6),
auch Deuterochloroform genannt, findet in der Kernresonanzspektroskopie (NMR)
als Lösungsmittel Verwendung.
865-49-6),
auch Deuterochloroform genannt, findet in der Kernresonanzspektroskopie (NMR)
als Lösungsmittel Verwendung.
Die Synthese erfolgt durch Umsetzung des Calciumsalzes der Trichloressigsäure mit schwerem Wasser.
Die physikalischen Eigenschaften unterscheiden sich geringfügig von der nichtdeuterierten Verbindung:[56]
- Schmelzpunkt: −64 °C
- Siedepunkt: 60,9 °C
- Dichte: 1,500 g/ml (25 °C)
- Brechungsindex: 1,444 (20 °C)
Literatur
- Albert Faulconer, Thomas Edward Keys: Chloroform. In: Foundations of Anesthesiology. 2 Bände, Charles C Thomas, Springfield (Illinois) 1965, Band 1, S. 442–481.
- Franz Hartmann: Beitrag zur Literatur über die Wirkung des Chloroforms. Ferber, Giessen 1855 (
 Digitalisat)
Digitalisat) - H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 12–14 und 25.
- M. Rossberg; W. Lendle; G. Pfleiderer, A. Tögel; T.R. Torkelson, K.K. Beutel: Chloromethanes, in: Ullmanns Enzyklopädie der Technischen Chemie, Wiley-VCH Verlag
GmbH & Co. KGaA, Weinheim 2012;
doi:
 10.1002/14356007.a06_233.pub3.
10.1002/14356007.a06_233.pub3.
Einzelnachweise
- ↑ Hochspringen nach: a b
c d e
f g h
i j k Eintrag zu
 Trichlormethan in der GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung.
Trichlormethan in der GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung.
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Dipole Moments, S. 9-58.
- ↑ Datenblatt
 Chloroform bei Sigma-Aldrich
(
Chloroform bei Sigma-Aldrich
( PDF).
PDF).
- ↑ Eintrag zu
 Chloroform im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA).
Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
Chloroform im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA).
Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung
 erweitern.
erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva):
 Grenzwerte – Aktuelle MAK- und BAT-Werte
(Suche nach 67-66-3 bzw. Chloroform).
Grenzwerte – Aktuelle MAK- und BAT-Werte
(Suche nach 67-66-3 bzw. Chloroform).
- ↑ G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis.
Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing,
S. 24–39; Table 8.SM.16
(
 ipcc.ch [PDF;
15,5 MB]).
ipcc.ch [PDF;
15,5 MB]).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-19.
- ↑
 Chloroform in der Notable Names Database (englisch)
Chloroform in der Notable Names Database (englisch)
- ↑ Justus Liebig: Ueber die Verbindungen, welche durch die Einwirkung des Chlors auf Alkohol, Aether, ölbildndes Gas
und Essiggeist entstehen. In: Annalen der Pharmacie. Band 1, 1832, S. 182–230
(
 Digitalisat in der Google-Buchsuche).
Digitalisat in der Google-Buchsuche).
- ↑ Jean-Baptiste-André Dumas: Recherches relatives à l’action du chlore sur l’alcool. In: L’Institut. Journal général des société et travaux scientifiques des la France et l’étranger. Band 2, (5. April) 1834, S. 106–108.
- ↑ Jean-Baptiste-André Dumas: Untersuchung über die Wirkung des Chlors auf den Alkohol. In: Annalen der
Physik und Chemie. Neue Folge, Band 31, 1834, S. 650–673
(
 Digitalisat auf
Gallica).
Digitalisat auf
Gallica).
- ↑ Albert Faulconer, Thomas Edward Keys: Chloroform. In: Foundations of Anesthesiology. 2 Bände, Charles C Thomas, Springfield (Illinois) 1965, Band 1, S. 442–481, hier: S. 442 f., 455–462.
- ↑ J. Y. Simpson: On a new anaesthetic agent, more efficient than sulphuric ether. In: Lancet, II.
Band 17, (20. November) 1847, S. 549 f. (
 Digitalisat in der Google-Buchsuche).
Digitalisat in der Google-Buchsuche).
- ↑ James Young Simpson: On a new anaesthetic agent, more efficient than sulfuric ether. In: Lancet, II. Band 17, 1847. S. 549 ff.
- ↑ Ray J. Defalque, Amos J. Wright: The Discovery of Chloroform: Has David Waldie's Role Been Exaggerated? In:
Anesthesiology. Band 114, Nr. 4, 2011, S. 1004–1005,
 doi:10.1097/ALN.0b013e31820ca94c.
doi:10.1097/ALN.0b013e31820ca94c.
- ↑ www.annethousemuseum: zu David Waldie.
- ↑ Ulrich von Hintzenstern, Wolfgang Schwarz: Frühe Erlanger Beiträge zur Theorie und Praxis der Äther- und Chloroformnarkose. Teil 1: Heyfelders klinische Versuche mit Äther und Chloroform. In: Der Anaesthesist. Band 45, Heft 2, 1996, S. 131–139.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 13.
- ↑ Michael Heck, Michael Fresenius: Repetitorium Anaesthesiologie. Vorbereitung auf die anästhesiologische Facharztprüfung und das Europäische Diplom für Anästhesiologie. 3., vollständig überarbeitete Auflage. Springer, Berlin / Heidelberg / New York u. a. 2001, ISBN 3-540-67331-8, S. 803.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 11.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. 1973, S. 13.
- ↑ Rudolf Frey, Otto Mayrhofer, mit Unterstützung von Thomas E. Keys und John S. Lundy: Wichtige Daten aus der Geschichte der Anaesthesie. In: R. Frey, Werner Hügin, O. Mayrhofer (Hrsg.): Lehrbuch der Anaesthesiologie und Wiederbelebung. Springer, Heidelberg/Basel/Wien 1955; 2., neubearbeitete und erweiterte Auflage. Unter Mitarbeit von H. Benzer. Springer, Berlin/Heidelberg/New York 1971, ISBN 3-540-05196-1, S. 13–16, hier: S. 14.
- ↑ Otto Mayrhofer: Gedanken zum 150. Geburtstag der Anästhesie. In: Der Anaesthesist. Band 45, 1996, S. 881–883, hier: S. 881.
- ↑ Trumpp: Chloroformnarkose ohne Maske mittels Kehlkopfkanüle. In: Münchner medizinische Wochenschrift.
Band 10, 1902 (
 online).
online).
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. 1973, S. 21 f.
- ↑ Heinrich L’Allemand: Wiederbelebung. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 217–228, hier: S. 219.
- ↑ Vgl. H. Orth, I. Kis: Schmerzbekämpfung und Narkose. 1973, S. 13 f.
- ↑ Vgl. auch E. H. Embley: The causation of death during the administration of chloroform. In: British medical Journal. Band 1, 1902, S. 817, 885 und 951.
- ↑ Christoph Weißer: Chloroform. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. De Gruyter, Berlin 2005, ISBN 3-11-015714-4, S. 257.
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 59.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. 1973, S. 21 f.
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 58.
- ↑ Ulrich Koppitz, Alfons Labisch, Norbert Paul: Historizität: Erfahrung und Handeln,
Geschichte und Medizin. Franz Steiner Verlag, Stuttgart 2004, ISBN 3-515-08507-6,
S. 234
(
 eingeschränkte Vorschau in der Google-Buchsuche).
eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ N. P. Krakow: Über die Hedonal-Chloroformnarkose. In: Archiv für experimentelle Pathologie und Pharmakologie. Supplement 317, 1908.
- ↑
 WDR1 – Stichtag 9. November 2007 – Vor 160 Jahren: Erste Entbindung mit Chloroform-Narkose.
WDR1 – Stichtag 9. November 2007 – Vor 160 Jahren: Erste Entbindung mit Chloroform-Narkose.
- ↑ Homepage Klinikum Dortmund Allgemeines zur Geschichte der Anästhesie.
- ↑ Ludwig Brandt, Karl-Heinz Krauskopf: „Eine Entdeckung in der Chirurgie“. 150 Jahre Anästhesie. In: Der Anaesthesist. Band 45, 1996, S. 970–975, hier: S. 971.
- ↑ Ludwig Burkhardt: Die intravenöse Narkose mit Äther und Chloroform. In: Münchner medizinische Wochenschrift. Band 2, 1909, S. 2365 ff.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 16.
- ↑ Otto Mayrhofer: Gedanken zum 150. Geburtstag der Anästhesie. In: Der Anaesthesist. Band 45, 1996, S. 881–883, hier: S. 882 f.
- ↑ Schadstofflexikon: Trichlormethan (Chloroform)
- ↑ Sigma-Aldrich:
 Chloroform.
Chloroform.
- ↑ Chemgapedia: Synthese von Trichlormethan.
- ↑ Stull, D.R.: Vapor Pressure of Pure Substances. Organic and Inorganic Compounds in
Ind. Eng. Chem. 39 (1947), S. 517–540,
 doi:10.1021/ie50448a022.
doi:10.1021/ie50448a022.
- ↑ Hochspringen nach: a b R. M. Stephenson:
Mutual Solubilities: Water-Ketones, Water-Ethers, and Water-Gasoline-Alcohols in J. Chem. Eng. Data 37 (1992), S. 80–95,
 doi:10.1021/je00005a024.
doi:10.1021/je00005a024.
- ↑ Hochspringen nach: a b I. M. Smallwood: Handbook of organic solvent properties. Arnold, London 1996, ISBN 0-340-64578-4, S. 142–143.
- ↑ Arnim Henglein, Hans Mohehauer: Die Zersetzung des Chloroforms durch Gamma-Strahlen und durch Ultraschallwellen. In: Zeitschrift für Physikalische Chemie. Band 18, 1958, S. 43–55.
- ↑ Lutz Roth, Ursula Weller: Gefährliche Chemische Reaktionen. ISBN 3-609-73090-0, ecomed Sicherheit, 2005.
- ↑ Eintrag „Chloroform“ im Lexikon der gesamten Technik (1905)
- ↑ Eintrag zu Isonitrile. In: Römpp Online. Georg Thieme Verlag.
- ↑ Nicolas Berend: Zur Chloroform-Casuistic. Hannover 1850.
- ↑ H. Orth, I. Kis: Schmerzbekämpfung und Narkose. 1973, S. 13 f.
- ↑ Vgl. etwa A. G. Levy: Sudden death under light chloroform anesthesia. In: Journal of Physiology. Band 32, Teil III, 1911.
- ↑ Vgl. H. Orth, I. Kis: Schmerzbekämpfung und Narkose. 1973, S. 13 f.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Deuterochloroform:
CAS-Nummer:
 865-49-6,
EG-Nummer: 212-742-4, ECHA-InfoCard:
865-49-6,
EG-Nummer: 212-742-4, ECHA-InfoCard:
 100.011.585,
PubChem:
100.011.585,
PubChem:  71583,
ChemSpider:
71583,
ChemSpider:
 64654
64654
- ↑ Datenblatt Chloroform-d 99.8 atom % D bei Sigma-Aldrich (PDF).


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 10.05. 2025

