
Butanon
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| MAK |
| ||||||||
| Toxikologische Daten |
| ||||||||
Butanon ist neben Aceton eines der wichtigsten industriell genutzten Ketone. Es ist eine farblose, leicht bewegliche Flüssigkeit mit einem typischen Geruch und wird allgemein als Methylethylketon (MEK) bezeichnet.
Nomenklatur
Butanon ist isomer zum entsprechenden Aldehyd namens Butyraldehyd.
Gewinnung und Darstellung
Butanon wird teilweise durch Hydratation von 2-Buten und anschließender Dehydrierung des entstandenen 2-Butanols hergestellt. Eine andere Möglichkeit ist die direkte katalytische Oxidation von n-Butan. Eine biotechnologische Herstellung aus Butan-2,3-diol basiert auf nachwachsenden Rohstoffen.
Eigenschaften
Physikalische Eigenschaften
Butanon ist eine farblose, niedrigviskose Flüssigkeit mit einem typischen ketonartigen Geruch, der dem von Aceton sehr ähnlich ist. Die Verbindung siedet unter Normaldruck bei 79,6 °C. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 3,9894, B = 1150,207 und C = −63,904. Die Verbindung bildet mit einer Reihe von Lösungsmitteln azeotrop siedende Gemische. Die azeotropen Zusammensetzungen und Siedepunkte finden sich in der folgenden Tabelle. Keine Azeotrope werden mit Toluol, m-Xylol, Ethylbenzol, 1-Propanol, n-Butanol, iso-Butanol, sec-Butanol, Allylalkohol, Aceton, 1,4-Dioxan, Methylacetat, Isopropylacetat, n-Butylacetat, Isobutylacetat, Ameisensäure und Essigsäure gebildet.
| Azeotrope mit verschiedenen Lösungsmitteln | |||||||||||
| Lösungsmittel | Wasser | n-Hexan | n-Heptan | Cyclohexan | Benzol | Chloroform | Tetrachlorkohlenstoff | ||||
| Gehalt Butanon | in % (m/m) | 88,7 | 29,5 | 71,3 | 44,1 | 44,3 | 83 | 29 | |||
| Siedepunkt | in °C | 73,4 | 64,3 | 77,0 | 71,8 | 78,4 | 80 | 74 | |||
| Lösungsmittel | Methanol | Ethanol | 2-Propanol | tert-Butanol | Ethylacetat | Methylpropionat | Diisopropylether | Di-n-propylether | |||
| Gehalt Butanon | in % (m/m) | 32,8 | 60,9 | 70,4 | 69,0 | 18,0 | 60,0 | 16,2 | 74,6 | ||
| Siedepunkt | in °C | 63,9 | 74,0 | 77,5 | 78,7 | 77,0 | 79,0 | 66,8 | 78,3 | ||
Die Mischbarkeit mit Wasser ist begrenzt. Mit steigender Temperatur sinkt die Löslichkeit von Butanon in Wasser bzw. steigt die Löslichkeit von Wasser in Butanon.
-
Löslichkeiten zwischen Butanon und Wasser Temperatur °C 0 9,6 19,3 29,7 39,6 49,7 60,6 70,2 Butanon in Wasser in % (m/m) 35,7 31,0 27,6 24,5 22,0 20,6 18,0 18,2 Wasser in Butanon in % (m/m) 10,9 11,1 11,2 11,3 11,7 11,9 13,4 13,7
Wichtige thermodynamische Größen werden in der folgenden Tabelle gegeben:
| Eigenschaft | Typ | Wert [Einheit] | Bemerkungen |
|---|---|---|---|
| Standardbildungsenthalpie | ΔfH0liquid ΔfH0gas |
−273,3 kJ·mol−1 −238,1 kJ·mol−1 |
als Flüssigkeit als Gas |
| Verbrennungsenthalpie | ΔcH0liquid | −2444,2 kJ/mol | als Flüssigkeit |
| Wärmekapazität | cp | 158,91 J·mol−1·K−1 (25 °C) 2,204 J·g−1·K−1 (25 °C) |
als Flüssigkeit |
| Kritische Temperatur | Tc | 535,7 K | |
| Kritischer Druck | pc | 41,5 bar | |
| Kritische Dichte | ρc | 3,74 mol·l−1 | |
| Schmelzenthalpie | ΔfH | 8,439 kJ·mol−1 | beim Schmelzpunkt |
| Verdampfungsenthalpie | ΔVH | 31,3 kJ·mol−1 | beim Normaldrucksiedepunkt |
Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=A·e(−βTr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 51,87 kJ/mol, β = 0,2925 und Tc = 536,8 K im Temperaturbereich zwischen 298 K und 371 K beschreiben.
| Strukturformel | |
|---|---|
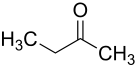
| |
| Allgemeines | |
| Name | Butanon |
| Andere Namen |
|
| Summenformel | C4H8O |
| Kurzbeschreibung | leichtentzündliche, farblose, acetonähnlich riechende Flüssigkeit |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 78-93-3 |
| EG-Nummer | 201-159-0 |
| ECHA-InfoCard | 100.001.054 |
| PubChem | 6569 |
| Eigenschaften | |
| Molare Masse | 72,11 g/mol |
| Aggregatzustand | flüssig |
| Dichte | 0,805 g/cm3 |
| Schmelzpunkt | −86 °C |
| Siedepunkt | 79,6 °C |
| Dampfdruck |
|
| Löslichkeit | leicht löslich in Wasser (292 g/l bei 20 °C) |
| Brechungsindex | 1,3788 (20 °C) |
Chemische Eigenschaften
2-Butanon ist bei Raumtemperatur und in Abwesenheit von Luftsauerstoff stabil. In Gegenwart von Luftsauerstoff können bei längerer Lagerung Peroxide gebildet werden. Die gezielte Oxidation mit Luftsauerstoff mittels Katalysatoren führt zum Diacetyl. Die Reaktion mit Amylnitrit führt zur Oxidation in α-Position zum Monooxim des Diacetyls.
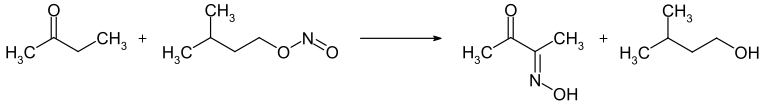
Die Umsetzung mit Wasserstoffperoxid ergibt das Methylethylketonperoxid, welches als Polymerisationsinitiator verwendet werden kann. Die Reaktion mit Salpetersäure oder anderen starken Oxidationsmitteln führt zu einem Gemisch aus Ameisensäure und Propionsäure. Die Selbstkondensation führt im basischen bzw. sauren Medium zu unterschiedlichen Reaktionsprodukten. Unter basischer Katalyse reagiert die Carbonylfunktion mit der Methylgruppe, während unter sauren Bedingungen die Methylengruppe α-Position die Carbonylfunktion angreift.
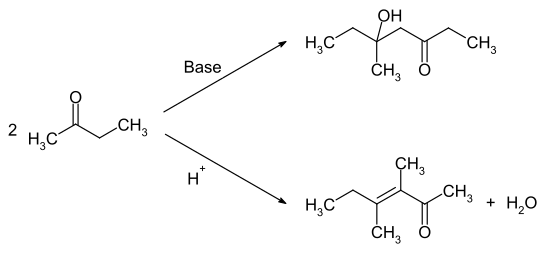
Die Kondensation mit Formaldehyd ergibt das Methylisopropylketon. 2-Butanon bildet mit Cyanwasserstoff sowie mit Natriumhydrogensulfit bzw. Kaliumhydrogensulfit Additionsprodukte. Durch die Umsetzung mit Hydroxylamin erhält man das 2-Butanonoxim. Die Halogenierung erfolgt in α-Position zur Ketogruppe. Mit Grignard-Verbindungen werden tertiäre Alkohole gebildet.
Sicherheitstechnische Kenngrößen
Butanon bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt bei −7,5 °C. Der Explosionsbereich liegt zwischen 1,5 Vol.-% (45 g/m3) als untere Explosionsgrenze (UEG) und 12,6 Vol.-% (378 g/m3) als obere Explosionsgrenze (OEG). Mit einer Mindestzündenergie von 0,27 mJ sind Dampf-Luft-Gemische extrem zündfähig. Der maximale Explosionsdruck beträgt 9,3 bar. Mit steigender Temperatur und reduziertem Ausgangsdruck sinkt der maximale Explosionsdruck. Die Sauerstoffgrenzkonzentration liegt bei 20 °C bei 9,5 Vol.-%. Tendenziell steigt der Wert mit sinkenden Druck bzw. verringert sich mit steigender Temperatur. Die Grenzspaltweite wurde mit 0,85 mm bestimmt. Es resultiert damit eine Zuordnung in die Explosionsgruppe IIB. Die Zündtemperatur beträgt 475 °C. Der Stoff fällt somit in die Temperaturklasse T1. Die elektrische Leitfähigkeit ist mit 3,6·10−7 S·m−1 eher gering.
-
Maximaler Explosionsdruck und Sauerstoffgrenzkonzentration unter reduziertem Druck Druck in mbar 1013 600 400 300 200 150 100 Maximaler Explosionsdruck in bar bei 20 °C 9,5 5,7 2,7 1,8 1,4 0,9 bei 100 °C 7,5 4,6 3,1 1,5 0,7 Sauerstoffgrenzkonzentration in Vol% bei 20 °C 9,5 9,5 9,9 bei 100 °C 8,5 8,5 8,7 9,1 12,5
Verwendung
Butanon ist wie Aceton ein gutes Lösungsmittel, in dem eine Vielzahl von Kunststoffen, Harzen und Lacken gelöst werden kann. Daneben wird es auch zur Entparaffinierung von Schmierölen, Entfettung von Metalloberflächen, Extraktion von Fetten und Ölen aus natürlichen Harzen, als künstlicher Aromastoff und zur Sterilisation medizinischer Instrumente verwendet. Durch die Reaktion von Butanon mit Wasserstoffperoxid entsteht Methylethylketonperoxid, ein wichtiger Radikalstarter für die Polymerisation von Polyesterharzen. Seit 1962 wird es in Deutschland wegen des ähnlichen Siedepunktes als Vergällungsmittel für Ethanol verwendet.
2001 wurden global 950.000 Tonnen Butanon verwendet.
Sicherheitshinweise/Toxikologie
Die Auswirkungen von Butanon auf die menschliche Gesundheit und die Umwelt werden unter REACH im Jahr 2018 im Rahmen der Stoffbewertung von Schweden geprüft.


© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 08.11. 2025

