Kritischer Punkt (Thermodynamik)

In der Thermodynamik ist ein kritischer Punkt ein Extremwert einer Binodalen, an dem letztere ein Minimum oder ein Maximum des
Drucks
und der Temperatur
durchläuft.[1][2][3] Kritische Punkte treten in Zustandsräumen thermodynamischer Systeme auf,
in denen eine Binodale ein Koexistenzgebiet, in dem koexistierende Phasen stabil sind, von einem Bereich abtrennt,
in dem eine homogene Phase stabil ist. Bei thermodynamischen Systemen, die kritische Punkte aufweisen, kann
es sich beispielsweise um Reinstoffe handeln, in deren Zustandsraum Koexistenzgebiete zwischen einer flüssigen
Phase und einer Gasphase existieren.[4] Weiterhin können flüssige Gemische, die eine Mischungslücke aufweisen, kritische Punkte besitzen.[5][6]
Alle in der Umgebung des kritischen Punktes existierenden Phasen, also sowohl die koexistierenden Phasen des Koexistenzgebietes als auch die homogene Phase außerhalb, sind Fluide – also Phasen, in denen die einzelnen Teilchen sich frei im Raum bewegen können (physikalisch formuliert: Translationsbewegungen vollführen können). Hierunter fallen Gase, Flüssigkeiten inklusive flüssiger Mischungen sowie überkritische Fluide (siehe unten).[7][8] Kritische Punkte sind dabei thermodynamische Zustände, in denen die koexistierenden Phasen des Koexistenzgebietes und die homogene Phase außerhalb ununterscheidbar werden.
Das Konzept "kritischer Punkt" wird in der Festkörperphysik analog angewendet, um das Phasenverhalten magnetischer und ferroelektrischer Materien unterhalb der Curie-Temperatur zu beschreiben.[9][10]
Kritische Punkte im Zustandsraum thermodynamischer Systeme
Binodalen trennen im Zustandsraum des betrachteten thermodynamischen Systems Zustände, in denen ein thermodynamisches System im Gleichgewicht als homogene Phase vorliegt, von Zuständen, in denen das thermodynamische System im Gleichgewicht koexistierende Phasen ausbildet. Koexistierende Phasen müssen im Gleichgewicht denselben Druck und dieselbe Temperatur aufweisen,[11] unterscheiden sich aber zumindest in einer weiteren Zustandsgröße. Daher entsprechen den koexistierenden Phasen jeweils Zustandspunkte gleichen Drucks und gleicher Temperatur, die beiderseits des kritischen Punktes auf der Binodalen lokalisiert sind und die sich zumindest in einer weiteren Zustandsgröße unterscheiden. Diese Zustandspunkte werden jeweils durch Konoden verbunden, die innerhalb des Koexistenzgebietes auf den jeweiligen Isobaren und Isothermen liegen.
Die zu kritischen Punkten gehörenden Drücke werden als kritische Drücke
, die zu kritischen Punkten gehörenden Temperaturen als kritische Temperaturen
bezeichnet. Nähert man Druck und Temperatur des betrachteten thermodynamischen Systems
und
an, wandern die den koexistierenden Phasen entsprechenden Zustandspunkte auf der Binodalen in Richtung des kritischen Punktes, bis sie sich dort treffen. Entsprechend
nimmt die Länge der Konode immer weiter ab, bis diese im kritischen Punkt gleich null wird. Die Werte der Zustandsgrößen, in denen sich die koexistierenden Phasen
unterscheiden, nähern sich ebenso wie deren chemische Potentiale einander an und werden im
kritischen Punkt identisch. Da somit die koexistierenden Phasen als solche im kritischen Punkt identisch werden, bilden diese dort eine einheitliche homogene Phase.
Am kritischen Punkt treffen sich die kritische Isobare (Isobare bei
), die kritische Isotherme (Isotherme bei
)
und die kritischen Isolinien der Zustandsgrößen, in denen sich die koexistierenden Phasen unterscheiden. Die kritische
Isobare sowie die kritische Isotherme weisen dabei am kritischen Punkt einen Horizontalwendepunkt auf.[12] Weiterhin sind kritische Punkte die einzigen gemeinsamen Punkte von Binodalen und
Spinodalen.[13]
Projiziert man den Zustandsraum eines thermodynamischen Systems, das einen kritischen Punkt aufweist, in die Druck-Temperatur-Ebene, werden die Binodale sowie das
Koexistenzgebiet im so erhaltenen Phasendiagramm durch eine Phasengrenzlinie repräsentiert, die am kritischen Punkt bei
und
endet. Der Grund hierfür ist, dass die Äste der Binodalen beiderseits des kritischen Punktes in der Druck-Temperatur-Ebene aufeinander zu liegen kommen, da die koexistierenden
Phasen jeweils den gleichen Druck und die gleiche Temperatur aufweisen müssen.
Kritische Phänomene
In der Umgebung des kritischen Punktes werden die Eigenschaften einzelner Stoffe durch universelles kritisches Verhalten bezüglich diverser physikalischer Eigenschaften überlagert.[14][15]
Ein Beispiel für kritisches Verhalten ist kritische Opaleszenz.[1][15] Im Koexistenzgebiet in unmittelbarer Nähe des kritischen Punktes sind die Unterschiede zwischen den koexistierenden Phasen so klein, dass ein Übertritt von Teilchen von der einen zur anderen koexistierenden Phase nur mehr mit geringen Übertrittsbarrieren verbunden ist. Als Folge wechseln viele Teilchen die Phase. Aufgrund dessen verschwindet die makroskopische Trennung der koexistierenden Phasen in große homogene Bereiche, in denen nur jeweils eine der beiden Phasen vorliegt. Stattdessen tritt eine sehr feine Struktur aus beiden koexistierenden Phasen auf, deren charakteristische Längenskalen in der Nähe des kritischen Punktes so klein werden, dass es an diesen zur Streuung von sichtbarem Licht kommt. Als Folge bildet das betrachtete fluide thermodynamische System Schlieren und/oder wird trüb beziehungsweise opak.
In Gegenwart einer nichtkritischen (also unveränderlichen) Grenzfläche kann sich in der Umgebung des kritischen Punktes durch Benetzungsübergänge das Benetzungsverhalten einer flüssigen Mischung ändern.
Fluide Reinstoffe
Kritische Punkte in Zustandsräumen von Reinstoffen
Ein Reinstoff kann in seinem thermodynamischen Zustandsraum ein Koexistenzgebiet besitzen, in dem dieser als Flüssigkeit und als Gas koexistiert. Im einfachsten Fall wird
das Phasenverhalten des Reinstoffes durch die Zustandsgrößen Druck
, Temperatur
und Molvolumen
als Variablen beschrieben. Der Zustandsraum des Reinstoffes lässt sich dann als
dreidimensionales kartesisches Koordinatensystem darstellen, wobei die Variablen
,
und
an den Koordinatenachsen aufgetragen sind. Die Gleichgewichtszustände des Reinstoffes bilden in
dessen dreidimensionalem Zustandsraum eine Zustandsfläche, in der auch die Binodale und der kritische Punkt liegen. Die koexistierenden flüssigen und gasförmigen Phasen
des Koexistenzgebietes haben im Gleichgewicht jeweils denselben Druck und dieselbe Temperatur, unterscheiden sich aber in ihren
Dichten und ihren Molvolumina. Der bei größeren Dichten beziehungsweise kleineren Molvolumina links des kritischen
Punktes auftretende Ast der Binodalen wird als Siedekurve, der bei kleineren Dichten beziehungsweise größeren Molvolumina
rechts des kritischen Punktes auftretende Ast als Kondensationskurve oder Taukurve bezeichnet. Bei Annäherung von
und
an
und
wandern der Zustandspunkt, der auf der Siedekurve die koexistierende flüssige Phase repräsentiert, sowie der Zustandspunkt, der auf der Kondensationskurve die
koexistierende Gasphase repräsentiert, in Richtung des kritischen Punktes. Dabei nähern sich die Dichte und
beider koexistierender Phasen immer weiter an. Beide Äste der Binodalen treffen sich am kritischen Punkt, wo sich die Dichten und Molvolumina von flüssiger und gasförmiger
Phase angleichen.[12] Die Unterschiede zwischen flüssigem und gasförmigem
Aggregatzustand hören am kritischen Punkt auf zu existieren. Auf
molekularer Ebene lässt sich das Verhalten der flüssigen und der gasförmigen Phasen bei Annäherung an den kritischen
Punkt anschaulich beschreiben: Wird ein Gas einem immer höheren Druck ausgesetzt, so verringern sich die mittleren Abstände zwischen den Gasmolekülen kontinuierlich.
Bei Erreichen des kritischen Drucks werden die mittleren Abstände dann genau so groß wie zwischen den Molekülen in der flüssigen Phase; es ist kein Unterschied mehr feststellbar.
Der kritische Punkt
ist bei Reinstoffen durch drei kritische Zustandsgrößen ausgezeichnet:
- die kritische Temperatur
- den kritischen Druck
- die kritische Dichte
bzw. das kritische Molvolumen
Wird die Zustandsfläche eines Reinstoffes in die Druck-Temperatur-Ebene projiziert, kommen im so erhaltenen Druck-Temperatur-Phasendiagramm Siede- und Kondensationskurve aufeinander zu liegen und erscheinen als Dampfdruckkurve, deren unteres Ende der Tripelpunkt und deren oberes Ende der kritische Punkt ist.
Überkritische Fluide
Bei Temperaturen oberhalb der kritischen Temperatur und/oder Drücken oberhalb des kritischen Druckes tritt kein Phasenübergang zwischen flüssiger Phase und Gasphase auf, und es existieren keine Zustände, in denen koexistierende flüssige und gasförmige Phasen vorliegen. Fluide, die bei Temperaturen oberhalb der kritischen Temperatur und/oder Drücken oberhalb des kritischen Druckes vorliegen, werden als überkritisches Fluid oder, in Anlehnung an den betreffenden englischen Ausdruck supercritical, superkritisches Fluid bezeichnet. Da zwischen Flüssigkeit und überkritischem Fluid beziehungsweise zwischen Gas und überkritischem Fluid keine Phasengrenzlinien existieren, bilden Gas, Flüssigkeit und überkritisches Fluid eine einheitliche fluide Phase, die bei niedrigen Molvolumina und Temperaturen sowie hohen Drücken den Charakter einer Flüssigkeit, bei großen Molvolumina und hohen Temperaturen sowie niedrigen Drücken den Charakter eines Gases aufweist. Eine wichtige Eigenschaft von überkritischen Fluiden ist daher, dass diese keine Oberflächenspannung aufweisen. Am kritischen Punkt ist die Oberflächenspannung gleich null. Daraus folgt, dass es oberhalb des kritischen Punktes keinen "Siedeverzug" geben kann.[16]
Bei Zuständen oberhalb des kritischen Druckes oder der kritischen Temperatur kann ein Stoff in einem Behälter nicht gleichzeitig als Flüssigkeit und Gas in Form zweier unterscheidbarer Phasen vorliegen, und es kann sich kein Meniskus ausbilden.
Gase und Flüssigkeiten können auch ohne Phasenübergang ineinander umgewandelt werden, indem die entsprechenden Änderungen der Zustandsgrößen unter Umgehung des Koexistenzgebietes durch das überkritische Gebiet der Zustandsfläche erfolgen. Dieser Umstand wird bei der überkritischen Trocknung genutzt.
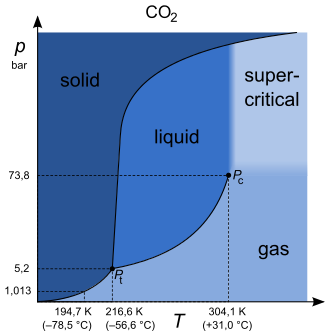
Beispiele für Reinstoffe, die häufig im überkritischen Zustand auftreten oder verwendet werden, sind Kohlenstoffdioxid und Wasser.
Kritische Temperatur und Druckverflüssigung
| Stoff | Temperatur | Druck | Dichte | ||
|---|---|---|---|---|---|
| Name | Formel | (K) | (°C) | (bar) | (kg/m3) |
| Chemische Elemente | |||||
| Wasserstoff | H2 | 33,19 | −239,96 | 13,15 | 30 |
| Deuterium | D2 | 38,2 | −234,9 | 16,5 | ? |
| Helium-3 | 3He | 3,30 | −269,85 | 1,12 | 41 |
| Helium | He oder 4He | 5,20 | −267,95 | 2,27 | 70 |
| Stickstoff | N2 | 126,19 | −146,96 | 33,96 | 313 |
| Sauerstoff | O2 | 154,60 | −118,55 | 50,46 | 427 |
| Fluor | F2 | 144,41 | −128,74 | 51,72 | ? |
| Neon | Ne | 44,49 | −228,66 | 27,69 | ? |
| Chlor | Cl2 | 416,90 | 143,75 | 79,91 | ? |
| Argon | Ar | 150,69 | −122,46 | 48,63 | ? |
| Brom | Br2 | 588 | 415 | 103,4 | ? |
| Krypton | Kr | 209,48 | −63,67 | 55,25 | ? |
| Xenon | Xe | 289,73 | 16,58 | 58,42 | 1103 |
| Caesium | Cs | 1938 | 1665 | 94 | ? |
| Radon | Rn | 377 | 104 | 62,8 | ? |
| Quecksilber | Hg | 1764 | 1491 | 1670 | ? |
| Organische Verbindungen | |||||
| Methan | CH4 | 190,56 | −82,59 | 45,99 | 163 |
| Ethan[18] | C2H6 | 305,33 | 32,18 | 48,71 | 205 |
| Propan | C3H8 | 369,82 | 96,67 | 42,48 | 221 |
| Butan | C4H10 | 425,13 | 151,98 | 37,96 | 228 |
| Kohlendioxid | CO2 | 304,13 | 30,98 | 73,77 | 468 |
| Methanol | CH3OH | 513,38 | 240,23 | 82,16 | 282 |
| Ethanol | C2H5OH | 513,90 | 240,75 | 61,48 | 276 |
| Anorganische Verbindungen | |||||
| Wasser | H2O | 647,10 | 373,95 | 220,64 | 322 |
| Ammoniak | NH3 | 405,40 | 132,25 | 113,59 | 225 |
| Fluorwasserstoff | HF | 461 | 188 | 64,9 | 290 |
| Monosilan | SiH4 | 269,7 | −3,5 | 48,45 | ? |
Eine besondere technische Bedeutung hat die kritische Temperatur
.
Dies ist die Temperatur, unterhalb derer ein Gas durch Druck verflüssigt werden kann, während dies oberhalb der kritischen Temperatur nicht mehr möglich ist. Die
Isotherme der kritischen Temperatur teilt damit das T-s-Diagramm
eines Stoffes in einen Bereich, bei dem Druckverflüssigung möglich ist, und in einen Bereich, in dem Druckverflüssigung nicht mehr möglich ist.
Diese Eigenschaft lässt sich im T-s-Diagramm eines Stoffes für eine bestimmte Temperatur überprüfen, wenn man zu einer bestimmten Temperatur die Isotherme verfolgt, bei der das Gas gespeichert werden soll:
- Wenn die Isotherme bei steigendem Druck ins Nassdampfgebiet reicht (die Taulinie überschreitet), ist eine Verflüssigung bei dieser Temperatur und erhöhtem Druck möglich.
- Wenn die Isotherme dagegen oberhalb des Nassdampfgebietes über den kritischen Punkt in den überkritischen Bereich verläuft, ist bei dieser Temperatur nur eine Verdichtung, aber keine Verflüssigung möglich.
Kritischer Druck
Ein besonderes Verhalten von Flüssigkeiten zeigt sich, wenn sie in flüssigem Zustand unterhalb der kritischen Temperatur mit einem Druck oberhalb des kritischen
Druckes
beaufschlagt werden. Werden diese Flüssigkeiten erhitzt, so zeigt sich eine kontinuierliche Volumenvergrößerung unter Wärmezufuhr, ohne dass
sich in der Flüssigkeit irgendwann Dampfblasen bilden[19]. Die Moleküle des Fluids rücken einfach immer nur weiter
auseinander, die sprunghafte Änderung der physikalischen Eigenschaften, wie beim Sieden von Wasser unter Normaldruck, bleiben aus. Dieses Verhalten bestimmt beispielsweise
den Prozess in Kraftwerken, wo mit einer Speisewasserpumpe flüssiges Wasser mit überkritischem
Druck einem Wärmetauscher zugeführt wird, um es auf eine überkritische Temperatur zu
erhitzen. Am Ende des Wärmetauschers wird das überkritische Fluid der Dampfturbine zugeführt.
Experimentelle Beobachtung

2: Kritischer Punkt, Opaleszenz
3: Überkritisches Ethan, Fluid[20]
Der Übergang vom unterkritischen in den überkritischen Zustand lässt sich gut beobachten, da am kritischen Punkt eine deutlich sichtbare Änderung der Phasen stattfindet.
Die Stoffe werden dabei in dickwandigen Rohren aus Quarzglas unter Druck eingeschlossen. Unterhalb der kritischen Temperatur (beispielsweise etwa 304,2 K bei Kohlenstoffdioxid bzw. 305,41 K bei Ethan) ist das Rohr zum Teil mit der flüssigen Substanz, zum anderen Teil mit dem Dampf der Substanz gefüllt. Beide Phasen sind farblos, klar durchsichtig und durch die deutlich sichtbare Flüssigkeitsoberfläche (Phasengrenzfläche) getrennt. Beim Erwärmen unterhalb der kritischen Temperatur nimmt zunächst das Volumen der Flüssigkeit durch thermische Ausdehnung zu, während das Volumen des Dampfes infolge Kompression abnimmt. Hat die Substanz die kritische Temperatur erreicht, so bildet sich kurzzeitig ein dichter Nebel (kritische Opaleszenz), der sich nach wenigen Sekunden weiterer Erwärmung wieder auflöst. Dieser Nebel kann auch deutliche Färbungen aufweisen; CO2 und Ethan weisen keine Färbung auf, der Nebel ist weiß. Das Rohr ist danach mit einer einzigen homogenen, klar durchsichtigen Phase, dem überkritischen Fluid, gefüllt. Beim Abkühlen tritt wieder kurzzeitig Nebel auf, bevor sich die Substanz in eine flüssige und eine gasförmige Phase teilt.
Abschätzung und Berechnung
Die kritischen Zustandsgrößen können neben einer vergleichsweise aufwändigen empirischen Messung auch aus der Van-der-Waals-Gleichung abgeschätzt werden, wobei man sie hier auch zur Definition der Reduzierten Größen nutzt.
Neben diesen Zustandsgleichungen werden häufig auch Gruppenbeitragsmethoden wie etwa die Lydersen-Methode und die Joback-Methode verwendet, mit denen die kritischen Größen aus der Molekülstruktur bestimmt werden.
Entdeckung

Mit der zunehmenden Verbreitung von Dampfmaschinen im 18. Jahrhundert rückte auch die Untersuchung des Siedeverhaltens verschiedener Stoffe in das Interesse der Wissenschaft. Es stellte sich heraus, dass mit steigendem Druck auch die Siedepunktstemperatur ansteigt. Man nahm an, dass die Koexistenz von Flüssigkeit und Gas bis zu beliebig hohen Drücken möglich sei.
Erste Versuche, diese Annahme zu widerlegen, wurden 1822 vom französischen Physiker Charles Cagniard de la Tour unternommen. Der kritische Punkt wurde daher zeitweise auch als Cagniard de la Tour’scher Punkt bezeichnet.[21] 1869 konnte der irische Physiker und Chemiker Thomas Andrews anhand von Untersuchungen mit CO2 zeigen, dass es einen Punkt gibt, ab dem der Unterschied zwischen Gas und Flüssigkeit nicht mehr existiert, und der sich durch eine bestimmte Temperatur, einem bestimmten Druck und damit einer bestimmten Dichte auszeichnet. Diesen Punkt nannte er den „kritischen Punkt“. Vier Jahre später gab der niederländische Physiker Johannes Diderik van der Waals eine plausible Erklärung (siehe oben) für das Verhalten von Stoffen im überkritischen Bereich und lieferte auch eine mathematische Beschreibung.[21]
Im Anschluss kam in der Wissenschaft die Frage auf, ob es einen kritischen Punkt nicht nur beim Übergang von Flüssigkeit zu Gas, sondern auch beim Übergang vom Feststoff zu Flüssigkeit gebe, oberhalb dessen eine Flüssigkeit nicht mehr von einem Feststoff zu unterscheiden sei. In den 1940er-Jahren stellte jedoch Percy Williams Bridgman bei Versuchen mit über 10.000 bar Druck fest, dass ein solcher Punkt nicht existiert. Dafür wurde ihm 1946 der Nobelpreis für Physik verliehen.[21]
Anwendungen überkritischer Fluide
Überkritische Fluide kombinieren das hohe Lösevermögen von Flüssigkeiten mit der niedrigen Viskosität von Gasen. Somit weisen überkritische Fluide für viele Anwendungsszenarien vorteilhafte Eigenschaften auf. Nachteile der Anwendung überkritischer Fluide sind die erforderlichen hohen Drücke und/oder Temperaturen.
Überkritische Fluide werden beispielsweise als Lösungsmittel in solvothermalen Synthesen[22] sowie in der organischen Chemie[23] eingesetzt.
In überkritischem Wasser kann SiO2 gelöst werden. Beim Auskristallisieren am Impfkristall werden Einkristalle aus Quarz gebildet. Diese werden dann in kleine Stücke gesägt und als Schwingquarze in Quarzuhren eingesetzt.
Extraktionen mit überkritischen Fluiden werden als Destraktionen bezeichnet. Beispielsweise wurde überkritische CO2-Extraktion zur Entfrachtung von trockenem Altpapier von kritischen Inhaltsstoffen verwendet.[24] Überkritisches Wasser löst Fette aus Fleisch. Da sich vorher viele verschiedene Substanzen im Fett abgelagert haben, werden mit dieser Methode Medikamente und andere Substanzen aus dem Fleisch extrahiert und nachgewiesen. Eine Anwendung von überkritischem CO2 ist die Entkoffeinierung von Tee und Kaffee.
Bei Textilfärbeanwendungen kann die gute Löslichkeit des Farbstoffes im überkritischen Zustand ausgenutzt werden, um den Farbstoff aufzunehmen und in die Faser zu übertragen. Nach Abschluss des Vorgangs wird die überkritische Flüssigkeit entspannt und der restliche Farbstoff fällt fest aus.
Eine wichtige Anwendung überkritischer Fluide ist überkritisches Trocknen. Mit überkritischem CO2 lassen sich biologische Präparate, z. B. für die Rasterelektronenmikroskopie, sehr schonend trocknen. Dabei werden die Proben erst benetzt, das Wasser stufenweise gegen ein Lösemittel ausgetauscht (meist Aceton) und das Aceton mit überkritischem CO2 ausgetragen. Durch diese Vorgehensweise bleiben die Strukturen weitestgehend erhalten und es treten nur wenige Artefakte auf. Überkritisches Trocknen wird häufig zur Herstellung von Aerogelen aus Hydrogelen eingesetzt.[25][26]
Flüssige Gemische
Kritische Punkte in Zustandsräumen von Gemischen
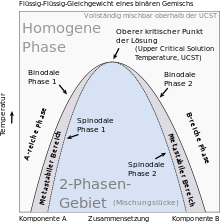
Kritische Punkte treten auch bei flüssigen Gemischen, die eine Mischungslücke aufweisen, auf. Dabei trennen Binodalen im Zustandsraum des Gemisches denjenigen Bereich, in dem das Gemisch als homogene Mischphase stabil ist, von der Mischungslücke ab. Innerhalb der Mischungslücke ist das Gemisch als homogene Mischphase nicht stabil und entmischt sich in koexistierende Phasen. Die innerhalb der Mischungslücke im Gleichgewicht vorliegenden koexistierenden Phasen enthalten die Komponenten des Gemisches in jeweils verschiedenen Anteilen, weisen aber dieselbe Temperatur und denselben Druck auf. Entsprechend werden die koexistierenden Phasen durch Zustandspunkte gleichen Druckes und gleicher Temperatur auf der Binodalen beiderseits des kritischen Punktes repräsentiert. Bewegt man beide Zustandspunkte auf der Binodalen durch entsprechende Druck- und Temperaturänderungen auf den kritischen Punkt zu, gleichen sich die Zusammensetzungen der koexistierenden Phasen immer weiter an. Am kritischen Punkt treffen sich die Zustandspunkte; die Zusammensetzungen der beiden koexistierenden Phasen des Koexistenzgebietes sowie der homogenen Mischphase außerhalb gleichen sich im kritischen Punkt an, so dass diese drei Phasen im kritischen Punkt ununterscheidbar werden.
Kritischer Punkt und Phasenseparation
Liegt ein Gemisch als homogene Mischphase mit der kritischen Zusammensetzung (der Zusammensetzung, die es auch am kritischen Punkt hat) vor, und wird dieses Gemisch mittels einer Druck- und Temperaturänderung in das Zweiphasengebiet überführt, durchläuft es dabei den kritischen Punkt. Da im kritischen Punkt Binodale und Spinodale zusammenfallen, wird das Gemisch automatisch in das von der Spinodalen umschlossene Gebiet überführt, in dem es als homogene Mischphase instabil ist. Es kommt daher spontan zu einer spinodalen Entmischung.[27][28]
Kritische Lösungstemperaturen
Die kritischen Temperaturen werden im Falle von Gemischen als kritische Lösungstemperaturen (englisch: critical solution temperatures) bezeichnet. Die Binodalen von Gemischen können dabei nach unten geöffnet sein und bei ihrer oberen kritischen Lösungstemperatur (englisch: upper critical solution temperature oder UCST)[29] ein Maximum als kritischen Punkt aufweisen. In diesem Fall liegt das Gemisch bei höheren Temperaturen als homogene Mischphase und bei niedrigeren Temperaturen phasensepariert in Form koexistierender Phasen vor. Insbesondere bei Gemischen, die Polymere enthalten, wie Polymerblends und Polymerlösungen, treten jedoch auch nach oben geöffnete Binodalen auf. Diese besitzen bei ihrer unteren kritischen Lösungstemperatur (englisch: lower critical solution temperature oder LCST) ein Minimum als kritischen Punkt. Dann liegt das Gemisch bei niedrigeren Temperaturen als homogene Mischphase und bei höheren Temperaturen phasensepariert in Form koexistierender Phasen vor.[30][31] Es existieren auch Beispiele geschlossener Mischungslücken, die von geschlossenen Binodalen mit einem oberen und einem unteren kritischen Punkt umfasst werden.[6]
Einzelnachweise
- ↑ Hochspringen nach: a b Pierre Papon, Jacques Leblond, Paul H. E. Meijer: The physics of phase transitions: concepts and applications. 2. Auflage. Springer-Verlag, Berlin / Heidelberg / New York 2006, ISBN 3-540-33390-8
- ↑ Bruno Predel, Michael Hoch, Monte Pool: Phase Diagrams and Heterogeneous Equilibria: a Practical Introduction. Springer-Verlag, Berlin, Heidelberg 2004, ISBN 3-662-09276-X
- ↑ Pablo G. Debenedetti: Metastable liquids: concepts and principles. Princeton University Press, Princeton, N.J. 1996, ISBN 0-691-08595-1, S. 69 ff.
- ↑
 IUPAC - critical point (C01396). In: Compendium of Chemical Terminology, 2nd ed. (the "Gold Book").
The International Union of Pure and Applied Chemistry (IUPAC).
IUPAC - critical point (C01396). In: Compendium of Chemical Terminology, 2nd ed. (the "Gold Book").
The International Union of Pure and Applied Chemistry (IUPAC).
- ↑ O. K. Rice: The effect of an impurity on the critical point of a binary
liquid system as a surface phenomenon. In: The Journal of Chemical Physics.
Band 64, Nr. 11, Juni 1976,
S. 4362–4367,
doi:
 10.1063/1.432105.
10.1063/1.432105.
- ↑ Hochspringen nach: a b Takeji Hashimoto: Structure of Polymer Blends. In: R. W. Cahn, P. Haasen, E. J. Kramer (Hrsg.): Materials Science and Technology: a Comprehensive Treatment. 12 Structure and Properties of Polymers. VCH, Weinheim 1993, ISBN 3-527-26813-8, S. 251–300.
- ↑ Hans-Jochen Foth:
 Fluid, RD-06-01312. In: Römpp online. Georg-Thieme-Verlag, Stuttgart, 2025.
Fluid, RD-06-01312. In: Römpp online. Georg-Thieme-Verlag, Stuttgart, 2025.
- ↑
 fluid.
In: Lexikon der Chemie. Spektrum Akademischer Verlag, Heidelberg, 1998.
fluid.
In: Lexikon der Chemie. Spektrum Akademischer Verlag, Heidelberg, 1998.
- ↑ Anneke Levelt Sengers, Robert Hocken, Jan V. Sengers:
Critical-point universality and fluids. In: Physics Today.
Band 30, Nr. 12, 1. Dezember 1977,
S. 42–51,
doi:
 10.1063/1.3037826.
10.1063/1.3037826.
- ↑ David E. Laughlin: Magnetic Transformations and Phase Diagrams.
In: Metallurgical and Materials Transactions A. Band 50,
Nr. 6, 15. Juni 2019, S. 2555–2569,
doi:
 10.1007/s11661-019-05214-z.
10.1007/s11661-019-05214-z.
- ↑ Kenneth Denbigh: The Principles of Chemical Equilibrium: With Applications in
Chemistry and Chemical Engineering. 4. Auflage, Cambridge University Press, Cambridge 1981, ISBN 0-521-28150-4,
 doi:10.1017/CBO9781139167604, S. 184.
doi:10.1017/CBO9781139167604, S. 184.
- ↑ Hochspringen nach: a b Klaus Stierstadt:
Thermodynamik - von der Mikrophysik zur Makrophysik. Springer-Verlag, Berlin/Heidelberg 2010, ISBN 978-3-642-05097-8, Kapitel 9,
doi:
 10.1007/978-3-642-05098-5.
10.1007/978-3-642-05098-5.
- ↑ J. B. Clarke, J. W. Hastie, L. H. E. Kihlborg, R. Metselaar und M. M. Thackeray: Definitions of terms
relating to phase transitions of the solid state (IUPAC Recommendations 1994). In: Pure and Applied Chemistry. Band 66, Nr. 3, 1994, S. 577–594,
 doi:10.1351/pac199466030577.
doi:10.1351/pac199466030577.
- ↑ A. Kumar, H.R. Krishnamurthy, E.S.R. Gopal: Equilibrium critical phenomena
in binary liquid mixtures. In: Physics Reports. Band 98,
Nr. 2, September 1983, S. 57–143,
doi:
 10.1016/0370-1573(83)90106-0.
10.1016/0370-1573(83)90106-0.
- ↑ Hochspringen nach: a b J. Charles Williamson:
Liquid–Liquid Demonstrations: Critical Opalescence. In: Journal of Chemical Education.
Band 98, Nr. 7, 13. Juli 2021,
S. 2364–2369,
doi:
 10.1021/acs.jchemed.0c01518.
10.1021/acs.jchemed.0c01518.
- ↑ Kit:
 Dampfexplosion- physikalische Grundlagen.
Karlsruhe Institute of Technology. (Pdf auto. Download)
Dampfexplosion- physikalische Grundlagen.
Karlsruhe Institute of Technology. (Pdf auto. Download)
- ↑ VDI-Gesellschaft Verfahrenstechnik und Chemieingenieurwesen (Hrsg.): VDI-Wärmeatlas. 11. Auflage. Springer-Verlag, Berlin Heidelberg 2013, ISBN 978-3-642-19980-6, Teil D.3 Thermophysikalische Stoffeigenschaften, D 3.1. Tabelle 1. Kritische und andere skalare Daten.
- ↑ Eintrag zu
 Ethan in der GESTIS-Stoffdatenbank des
Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
Ethan in der GESTIS-Stoffdatenbank des
Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
- ↑ Klaus Langeheinecke, André Kaufmann, Kay Langeheinecke, Gerd Thieleke: Thermodynamik für Ingenieure. 11. Auflage. Springer Fachmedien, Wiesbaden 2020, ISBN 978-3-658-30643-4, 3.3 Kritischer Punkt.
- ↑ Sven Horstmann: Theoretische und experimentelle Untersuchungen zum Hochdruckphasengleichgewichtsverhalten fluider Stoffgemische für die Erweiterung der PSRK-Gruppenbeitragszustandsgleichung, Doktorarbeit, Carl von Ossietzky Universität Oldenburg, 2000.
- ↑ Hochspringen nach: a b c Andreas Pfennig: Thermodynamik der Gemische. Springer Verlag, Berlin Heidelberg 2004, ISBN 3-540-02776-9, S. 7–8.
- ↑ K. Byrappa, T. Adschiri: Hydrothermal technology for nanotechnology.
In: Progress in Crystal Growth and Characterization of Materials. Band 53,
Nr. 2, Juni 2007, S. 117–166,
doi:
 10.1016/j.pcrysgrow.2007.04.001.
10.1016/j.pcrysgrow.2007.04.001.
- ↑ Phillip E. Savage: Organic Chemical Reactions in Supercritical Water.
In: Chemical Reviews. Band 99,
Nr. 2, 1. Februar 1999,
S. 603–622,
doi:
 10.1021/cr9700989.
10.1021/cr9700989.
- ↑
 Überkritische CO2-Extraktion.
Technische Universität Darmstadt.
Überkritische CO2-Extraktion.
Technische Universität Darmstadt.
- ↑ Antoine Bisson, Arnaud Rigacci, Didier Lecomte, Elisabeth Rodier, Patrick Achard:
Drying of Silica Gels to Obtain Aerogels:Phenomenology and Basic Techniques. In:
Drying Technology. Band 21,
Nr. 4, 6. Januar 2003, S. 593–628,
doi:
 10.1081/DRT-120019055.
10.1081/DRT-120019055.
- ↑ Somnath Basak, Rekha S. Singhal: The potential of supercritical drying
as a “green” method for the production of food-grade bioaerogels: A comprehensive critical review. In: Food Hydrocolloids.
Band 141, August 2023, S. 108738,
doi:
 10.1016/j.foodhyd.2023.108738.
10.1016/j.foodhyd.2023.108738.
- ↑ J. W. Cahn: Phase Separation by Spinodal Decomposition in Isotropic Systems.
In: Journal of Chemical Physics. Band 42, Nr. 1, 1965, S. 93–99,
 doi:10.1063/1.1695731.
doi:10.1063/1.1695731.
- ↑ J. W. Cahn: On spinodal decomposition. In: Acta Metallurgica. Band 9, Nr. 9, 1961, S. 795–801,
 doi:10.1016/0001-6160(61)90182-1.
doi:10.1016/0001-6160(61)90182-1.
- ↑ Eintrag zu upper critical solution temperature. In:
IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”.
doi:
 10.1351/goldbook.UT07280.
10.1351/goldbook.UT07280.
- ↑ Toshiaki Ougizawa, Takashi Inoue, Hans W. Kammer: UCST and LCST behavior
in polymer blends. In: Macromolecules. Band 18,
Nr. 10, Oktober 1985, S. 2089–2092,
doi:
 10.1021/ma00152a052.
10.1021/ma00152a052.
- ↑ Christian Wohlfarth, Upper Critical (UCST) and Lower Critical (LCST) Solution Temperatures of Binary Polymer Solutions, Polymer Handbook, 87th ed., CRC press, 2006, chapter 13, S. 19–34, ISBN 978-0-8493-0487-3.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 13.01. 2026