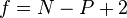Tripelpunkt

In der Thermodynamik ist der Tripelpunkt (auch Dreiphasenpunkt) der Zustand, beschrieben durch Druck und Temperatur, an dem drei Aggregatzustände eines Stoffes im thermodynamischen Gleichgewicht sind.
Der Tripelpunkt ist im Phasendiagramm der Schnittpunkt der beiden Phasengrenzlinien Sättigungsdampfdruck und Schmelzkurve.
Beispiel: Tripelpunkt des Wassers
Am Tripelpunkt kommen Wasserdampf, flüssiges Wasser und Eis gleichzeitig vor, und die Mengenverhältnisse der drei Phasen ändern sich nicht. Ständig verdampfen etwas Eis (Sublimation) und Wasser (Verdunstung) zu Wasserdampf, ebenso schmilzt etwas Eis zu Wasser. Gleichzeitig finden die drei gegenläufigen Prozesse im selben Umfang statt: Wasser gefriert, Wasserdampf kondensiert zu Wasser und friert direkt als Eis aus.
Wird dem System Wärme entzogen oder nimmt der Druck zu, wächst der Anteil des Eises zu Lasten von Wasser und Wasserdampf. Wird dem System Wärme zugeführt oder nimmt der Druck ab, schwindet der Anteil des Eises zugunsten von Wasser und Wasserdampf.
Der Tripelpunkt des Wassers liegt nach dem international akzeptierten Bestwert von Guildner, Johnson und Jones aus dem Jahre 1976 bei einem Druck von 611,657 (± 0,010) Pa (ca. 6 mbar) und einer Temperatur von – durch Festlegung der Temperaturskala selbst – exakt 273,16 K (0,01 °C).
Besonderheit Gibbssche Phasenregel
Der Tripelpunkt beschreibt auch gleichzeitig eine Besonderheit der Gibbsschen Phasenregel:
Der Freiheitsgrad f des Systems (eines Einkomponentensystems: N = 1 mit drei Phasen: P = 3) ist in Tripelpunkten nach der Phasenregel immer f = 0: Verändert man eine intensive Zustandsgröße, wird sofort das Gleichgewicht der Phasen verlassen. Dies ist auch der Grund dafür, dass es in einem einkomponentigen System keine 4 Phasengrenzlinien geben kann, die sich in einem Punkt treffen (hier wäre f = −1).
Skalenfixpunkte
Die Eindeutigkeit des Tripelpunkts liefert besonders gute Temperatur-Fixpunkte für die Kalibrierung der Skalen von Thermometern.
Gängige Tripelpunkt-Temperaturangaben, z. B. nach der Internationalen Temperaturskala von 1990, sind:
- Wasser: 273,16000 K (0,01000 °C = 32,018 °F = 491,688 °Ra) bei 611,657 ± 0,010 Pa
- Quecksilber: 234,31560 K (−38,83440 °C = −37,90192 °F = 421,76808 °Ra) bei 1,65·10−4 Pa


© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 26.07. 2025