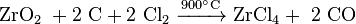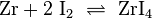Zirconium
| Sicherheitshinweise | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||
Zirconium, häufig auch Zirkonium, ist ein chemisches Element mit dem Elementsymbol Zr und der Ordnungszahl 40. Sein Name leitet sich vom Zirkon, dem häufigsten Zirconium-Mineral, ab. Im Periodensystem steht es in der 5. Periode; es ist das zweite Element der 4. Gruppe (veraltet 4. Nebengruppe) oder Titangruppe. Zirconium ist ein sehr korrosionsbeständiges Schwermetall. Biologische Funktionen sind nicht bekannt; es kommt in geringen Mengen (4 mg/kg) im menschlichen Organismus vor und ist nicht toxisch.
Geschichte
Das wichtige zirconiumhaltige Mineral Zirkon (Zr[SiO4]) ist als Schmuckstein bereits seit der Antike bekannt. Zirconium als Element wurde 1789 von Martin Heinrich Klaproth in einer aus Ceylon stammenden Probe des Minerals Zirkon entdeckt und nach diesem benannt. Erstmals dargestellt wurde das Metall 1824 von Jöns Jakob Berzelius durch Reduktion von K2ZrF6 mit Kalium. Dazu erhitzte er „ein Gemenge aus flusssaurem Zirkon-Kali mit Kalium in einer eisernen Röhre“. Nach Behandlung mit Wasser, Trocknen und längerem Erhitzen mit verdünnter Salzsäure erhielt Berzelius ein „klumpiges Pulver, welches wie Kohle schwarz“ war und erst „durch Zusammendrücken mit dem Polierstahl eine dunkelgraue Farbe und Glanz“ erhielt. Die korrekte Atommasse konnte dagegen erst 1924 bestimmt werden, da – neben Fehlern bei der Durchführung der Experimente - nicht bekannt war, dass Zirconium stets geringe Mengen Hafnium enthält. Ohne diese Information ergaben Messungen immer eine etwas zu hohe Atommasse. Die erste praktische Anwendung von Zirconium war der Einsatz als rauchloses Blitzlichtpulver.
Vorkommen
Zirconium kommt in der Erdkruste mit einem Gehalt von ca. 0,016 % vor. In der nach Häufigkeit geordneten Liste der Elemente steht Zirconium an 18. Stelle und ist häufiger als die bekannteren Elemente Chlor und Kupfer. Es ist zwar sehr weit verbreitet, findet sich aber meist nur in sehr geringen Mengen und in sehr kleinen Kristallen (typischerweise um 0,1 mm). Darum wurde Zirconium in früherer Zeit als selten angesehen. Zirconium wird vor allem in silikatischen Intrusivgesteinen wie Granit gefunden. Es kommt nicht gediegen, sondern nur in einigen Mineralen, vor allem als Zirkon (ZrSiO4) und Baddeleyit (ZrO2) sowie dem selteneren roten Eudialyt (Na4(CaCeFeMn)2ZrSi6O17(OHCl)2) gebunden vor. Es ist fast immer mit Hafnium vergesellschaftet. Zirkon ist – wegen seines hohen Schmelzpunktes von 2550 °C, seiner großen Härte und geringen Reaktivität – das älteste auf der Erde auffindbare Mineral und kann auf Grund eingelagerter Uran- und Thoriumisotope für radiometrische Altersbestimmungen verwendet werden.
Als Rohstoffe dienen meist sekundäre Lagerstätten, so genannte Seifenlagerstätten. Diese entstehen, wenn das umliegende Gestein verwittert und nur der besonders verwitterungsresistente Zirkon zurückbleibt. Weitere solche Lagerstätten können durch Wasserströmungen entstehen, die Zirkonkristalle ausspülen und an anderen Stellen anspülen. Primäre Lagerstätten haben dagegen meist einen für den rentablen Abbau zu geringen Zirconium-Gehalt.
Die wichtigsten Zirconium-Lagerstätten liegen in Australien, den USA und Brasilien. Bei abbauwürdigen Reserven von 38 Millionen Tonnen lag die Weltjahresförderung von Zirconiummineralen 2006 bei 920.000 Tonnen (gerechnet als Zirkon). Davon werden nur etwa 5 % zu Metall und Legierungen weiterverarbeitet. Die wichtigsten Förderländer waren 2006 mit großem Abstand Australien und Südafrika.
Gewinnung und Darstellung

Zirkon als häufigster Zirconium-Rohstoff muss vor der Weiterverarbeitung erst in Zirconiumdioxid umgewandelt werden. Dazu wird der Zirkon in einer Natriumhydroxid-Schmelze gekocht (alkalischer Aufschluss). Das Zirconiumdioxid wird danach mit Koks im Lichtbogen zu Zirconiumkarbonitrid (Kohlenstoff und stickstoffhaltiges Zirconium) und anschließend mit Chlor zu Zirconiumtetrachlorid umgesetzt.
Eine direkte Reduktion von Zirconiumdioxid mit Kohlenstoff (wie im Hochofenprozess) ist nicht möglich, da die hierbei entstehenden Carbide sehr schwer vom Metall zu trennen sind. Stattdessen wird Zirconiumtetrachlorid im so genannten Kroll-Prozess mit Magnesium in einer Helium-Atmosphäre zu Zirconiummetall reduziert.
Um reineres Zirconium gewinnen zu können, wird das Van-Arkel-de-Boer-Verfahren angewendet. Dabei reagiert während des Erhitzens unter Vakuum zunächst das Zirconium mit Iod zu Zirconium(IV)-iodid. Dieses wird an einem heißen Draht wieder zu Zirconium und Iod zersetzt:
Zirconiumtetraiodid bildet sich bei 200 °C aus Zirconium und Iod; es zerfällt wieder bei 1300 °C.
Zirconium und Hafnium sind auf einfache chemische Art nicht zu trennen. Deshalb enthält auch dieses hochreine Zirconium noch immer Hafnium. Da es für viele Anwendungen in der Reaktor-Technik wichtig ist, dass das Zirconium kein Hafnium mehr enthält, spielen Trennverfahren für diese beiden Metalle eine wichtige Rolle. Eine Möglichkeit sind Extraktionsverfahren, in denen die unterschiedliche Löslichkeit von Zirconium- und Hafniumverbindungen in speziellen Lösungsmitteln ausgenutzt wird. Häufig werden die Thiocyanate und ihre unterschiedliche Löslichkeit in Methylisobutylketon ausgenutzt. Weitere Möglichkeiten bieten Ionenaustauscher oder die fraktionierte Destillation von geeigneten Verbindungen.
| Eigenschaften | |
|---|---|
| Allgemein | |
| Name, Symbol, Ordnungszahl | Zirconium, Zr, 40 |
| Serie | Übergangsmetalle |
| Gruppe, Periode>, Block | 4, 5, d |
| Aussehen | silbrig weiß |
| CAS-Nummer | 7440-67-7 |
| Massenanteil an der Erdhülle | 0,021 % |
| Physikalisch | |
| Aggregatzustand | fest |
| Modifikationen | zwei (α-/β-Zr) |
| Kristallstruktur | hexagonal; |
| Dichte | 6,501 g/cm3 (25 °C) |
| Mohshärte | 5 |
| Magnetismus | paramagnetisch
(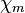 = 1,1 · 10−4)
= 1,1 · 10−4) |
| Schmelzpunkt | 2130 K (1857 °C) |
| Siedepunkt | 4650 K (4377 °C) |
| Molares Volumen | 14,02 · 10−6 m3/mol |
| Verdampfungswärme | 591 kJ/mol |
| Schmelzwärme | 16,9 kJ/mol |
| Dampfdruck | 0,00168 Pa bei 2125 K |
| Schallgeschwindigkeit | 4650 (long.), 2250 (trans.) m/s bei 293,15 K |
| Spezifische Wärmekapazität | 270,0 J/(kg · K) |
| Elektrische Leitfähigkeit | 2,36 · 106 A/(V · m) |
| Wärmeleitfähigkeit | 22,7 W/(m · K) |
| Chemisch | |
| Oxidationszustände | 4, 2 |
| Normalpotential | −1,553 V
(ZrO2 + 4 H+ + 4 e− → Zr + 2 H2O) |
| Elektronegativität | 1,33 (Pauling-Skala) |
Eigenschaften
Physikalische Eigenschaften
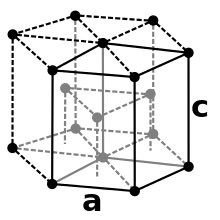
Zirconium ist ein silbrig-glänzendes Schwermetall (Dichte 6,501 g/cm3 bei 25 °C), es ähnelt äußerlich Stahl. Das Metall kristallisiert in zwei unterschiedlichen Modifikationen, in die es durch Temperaturänderung überführt werden kann. Unterhalb von 870 °C kristallisiert α-Zirconium im hexagonalen Kristallsystem (hexagonal-dichteste Kugelpackung, Magnesium-Typ) in der Raumgruppe P63/mmc mit den Gitterparametern a = 323 pm und c = 514 pm sowie zwei Formeleinheiten pro Elementarzelle. Bei 870 °C ändert sich die Kristallstruktur zur kubisch-innenzentrierten β-Struktur (Wolfram-Typ) mit der Raumgruppe Im3m und dem Gitterparameter a = 361 pm.
Zirconium ist relativ weich und biegsam. Es lässt sich gut durch Walzen, Schmieden und Hämmern verarbeiten. Durch geringe Verunreinigungen von Wasserstoff, Kohlenstoff oder Stickstoff im Metall wird es aber spröde und schwer zu verarbeiten. Die elektrische Leitfähigkeit ist nicht so gut wie die anderer Metalle. Sie beträgt nur etwa 4 % von der des Kupfers. Bezogen auf seine schlechte, elektrische Leitfähigkeit ist Zirkonium ein relativ guter Wärmeleiter. Im Vergleich zum leichteren Homologen Titan sind Schmelz- und Siedepunkt etwas höher (Schmelzpunkt: Titan: 1667 °C, Zirconium: 1857 °C). Auch die elektrische und Wärmeleitfähigkeit sind besser. Unterhalb von 0,55 K wird Zirconium supraleitend.
Die Eigenschaften des Zirconiums und des schwereren Homologen Hafnium ähneln sich auf Grund der Lanthanoidenkontraktion sehr. Diese bedingt ähnliche Atomradien (Zr: 159 pm, Hf: 156 pm) und damit ähnliche Eigenschaften. Die beiden Metalle unterscheiden sich allerdings erheblich in ihrer Dichte (Zr: 6,5 g/cm3, Hf: 13,3 g/cm3).
Eine wichtige Eigenschaft, wegen der Zirconium eine große Bedeutung im Reaktorbau erlangt hat, ist sein geringer Einfangquerschnitt für Neutronen. In dieser Eigenschaft unterscheidet sich Zirconium ebenfalls sehr vom Hafnium. Dies macht die aufwändigen Trennverfahren für diese Anwendungen nötig.
Chemische Eigenschaften
Zirconium ist ein unedles Metall, welches besonders unter hoher Temperatur mit vielen Nichtmetallen reagiert. Vor allem als Pulver verbrennt es mit weißer Flamme zu Zirconiumdioxid, bei Anwesenheit von Stickstoff auch zu Zirconiumnitrid und Zirconiumoxinitrid. Kompaktes Metall reagiert erst bei Weißglut mit Sauerstoff und Stickstoff. Bei erhöhtem Druck reagiert Zirconium auch bei Raumtemperatur mit Sauerstoff, da das gebildete Zirconiumoxid im geschmolzenen Metall löslich ist.
Zirconium ist an der Luft durch eine dünne, sehr dichte Zirconiumoxidschicht passiviert und deshalb reaktionsträge. Es ist darum in fast allen Säuren unlöslich, lediglich Königswasser und Flusssäure greifen Zirconium schon bei Raumtemperatur an. Wässrige Basen reagieren nicht mit Zirconium.
Isotope
Vom Zirconium sind viele Isotope zwischen 78Zr und 110Zr bekannt. Dabei ist natürliches Zirconium ein Mischelement, das aus insgesamt fünf Isotopen besteht. Dies sind 90Zr, das mit einem Anteil von 51,45 % des natürlichen Zirconiums am häufigsten vorkommt, sowie die schwereren Isotope 91Zr (11,32 %), 92Zr (17,19 %), 94Zr (17,28 %) und 96Zr mit 2,76 % Anteil. 96Zr ist als einziges natürliches Isotop schwach radioaktiv, es zerfällt mit einer Halbwertszeit von 24 · 1018 Jahren unter doppeltem Betazerfall zu 96Mo. Das Isotop 91Zr kann mit Hilfe der NMR-Spektroskopie nachgewiesen werden.
Verwendung

Eine wichtige Verwendung für Zirconium sind die aus Zircaloy hergestellten Hüllen der Uran-Brennelemente in Kernkraftwerken. Diese Legierung besteht aus ca. 90 % Zirconium und geringen Anteilen an Zinn, Eisen, Chrom oder Nickel, darf jedoch kein Hafnium enthalten. Der Grund für die Wahl dieses Elements ist der schon oben beschriebene geringe Einfangquerschnitt für thermische Neutronen bei gleichzeitig großer Korrosionsbeständigkeit, die es auch als Baumaterial für chemische Anlagen, vor allem für spezielle Apparateteile wie Ventile, Pumpen, Rohre und Wärmeaustauscher geeignet macht. Als Legierungszusatz zu Stahl erhöht es ebenfalls die Korrosionsbeständigkeit. Aus entsprechenden Legierungen werden unter anderem chirurgische Instrumente hergestellt.
Da Zirconium mit geringen Mengen Sauerstoff und Stickstoff reagiert, kann es als Gettermaterial in Glühlampen und Vakuumanlagen zur Aufrechterhaltung des Vakuums genutzt werden. Diese Eigenschaft wird auch in der Metallurgie ausgenutzt, um Sauerstoff, Stickstoff und Schwefel aus Stahl zu entfernen.
Wegen seiner Eigenschaft, beim Verbrennen ein sehr helles Licht auszusenden, wurde es neben Magnesium als Blitzlichtpulver verwendet. Im Gegensatz zu Magnesium hat Zirconium den Vorteil, rauchfrei zu sein. Diese Eigenschaft wird ebenso in Feuerwerkskörpern und Signallichtern ausgenutzt.
Zirconium sendet beim Aufprall auf Metalloberflächen einen Funkenschwall ab und ist brennbar. Dieses nutzt das Militär in einigen Munitionssorten wie der Schrotflinten-Spezialmunition Dragon's Breath und der US-amerikanischen Allzweck-Streumunition BLU-97 aus. In der Filmtechnik wird dieser Effekt für nicht-pyrotechnische Aufpralleffekte von beispielsweise Gewehrkugeln auf Metalloberflächen benutzt.
Zirconium-Niob-Legierungen sind supraleitend und bleiben dies auch, wenn starke Magnetfelder angelegt werden. Sie wurden daher früher für supraleitende Magnete verwendet.
Sicherheitshinweise
Es sind keine toxischen Effekte von Zirconium und seinen Verbindungen bekannt. Wegen der dichten Oxidschicht ist kompaktes Zirconium nicht brennbar. In Pulverform kann es dagegen beim Erhitzen an der Luft anfangen zu brennen. Zirconiumbrände sind sehr gefährlich, da zum Löschen weder Wasser (heftige Reaktion unter Wasserstoffbildung), noch Kohlenstoffdioxid oder Halon verwendet werden können. Zirconiumbrände müssen mit Metallbrandlöschern (Klasse D) oder trockenem Sand gelöscht werden.
Nachweis
Mit Alizarinrot-S bildet Zirconium
im Sauren eine charakteristische rot-violette Verbindung (Farblack), welche bei
Zugabe von Fluoridionen unter Bildung des Zirconium-Fluorokomplexes wieder
verschwindet. Diese Reaktion kann als qualitativer Nachweis sowohl von Zirconium
als auch von Fluor dienen. Da schon geringe Mengen Fluorid (und anderer Anionen)
stören, ist dieser Nachweis für Mineralanalysen ungeeignet.
Daneben sind einige andere organische Verbindungen, wie Tannin, Kupferron, Phenylarsonsäure,
Oxin oder Xylenolorange, als
Nachweisreagenz geeignet. Eine weitere charakteristische Verbindung ist
Zirconiumoxidchlorid ZrOCl2 · 8 H2O, die in typischen
Nadeln kristallisiert. In der modernen Analytik
kann Zirconium über Atomabsorptionsspektrometrie
(AAS) oder Massenspektrometrie
(auch anhand des Isotopenmusters)
nachgewiesen werden.
Eine Möglichkeit zur quantitativen Analyse ist die Fällung
von schwerlöslichem Zirconiumhydroxid
mit Ammoniak und anschließendem
Verglühen zu Zirconiumdioxid.
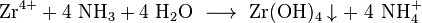
- Fällung des Hydroxids
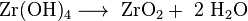
- Umsetzen zur Wägeform
Verbindungen
Zirconium bildet als unedles Metall eine Vielzahl von Verbindungen. Die meisten Zirconiumverbindungen sind Salze. Häufig sind sie sehr stabil und besitzen einen hohen Schmelzpunkt. Die Oxidationsstufe +IV ist bevorzugt und am stabilsten. Es sind aber auch Verbindungen in den Oxidationsstufen +III bis +I, bei Komplexen sogar in den Stufen 0, −I und −II bekannt.
Zirconiumdioxid

Die wichtigste Zirconiumverbindung ist Zirconiumdioxid ZrO2, ein sehr stabiles und hochschmelzendes Oxid. Zirconiumdioxid dient zur Herstellung feuerfester Auskleidungen in Tiegeln und Öfen. Um es hierfür zu verwenden, muss es aber zur Stabilisierung der kubischen Hochtemperaturphase mit Calciumoxid, Yttriumoxid oder Magnesiumoxid stabilisiert werden. Zirkoniumdioxid-verstärktes Aluminiumoxid (ZTA, Zirconia Toughened Aluminum Oxide) wird als Technische Keramik für hohe Temperaturen eingesetzt.
Zirconiumdioxid-Kristalle sind farblos und besitzen einen hohen Brechungsindex. Darum dienen sie unter dem Namen Zirkonia als künstlicher Schmuckstein und Ersatz für Diamanten. Daneben wird Zirconiumdioxid als Schleifmittel und wegen der weißen Farbe als Weißpigment für Porzellan genutzt.
Wird Zirconiumoxid mit Yttriumoxid dotiert, ergeben sich weitere Anwendungsmöglichkeiten. Bei drei Prozent Yttriumoxid-Gehalt wird das ZrO2 in einer verzerrten Fluorit-Struktur stabilisiert. Dadurch wirkt es bei Temperaturen von über 300 °C als Leiter für Sauerstoff-Ionen. Eine wichtige Anwendung hierfür ist die Lambdasonde in Autos, die zum Messen des Sauerstoffgehaltes in Abgasen für den Katalysator dient. Bei 15 % Yttriumoxidgehalt sendet Zirconiumoxid bei 1000 °C ein sehr helles, weißes Licht aus. Dieses findet in der so genannten Nernst-Lampe Anwendung. Da Yttrium-Zirconium-Keramiken eine extrem hohe Bruchzähigkeit besitzen, werden sie beispielsweise in der Zahntechnik als hochstabiles Kronen- und Brückengerüst, in künstlichen Hüftgelenken und Zahnimplantaten oder als Verbindungselement bei Teleskopen verwendet. Dabei lösen sie zunehmend Gold und andere Metalle in der Funktion ab.
Zirconiumoxid wird zudem oft für Kugellager verwendet. Vor allem für die Laufringe der Lager hat ZrO2 den großen Vorteil, dass der Wärmeausdehnungskoeffizient nahe dem von Stahl ist. Andere technische Keramiken wie Siliciumnitrid haben üblicherweise einen erheblich geringeren Wärmeausdehnungskoeffizienten.
Halogenide
Mit den Halogenen Fluor, Chlor, Brom und Iod bildet Zirconium mehrere Reihen von Verbindungen. Es sind von allen Halogenen Verbindungen der Formen ZrX4, ZrX3 und ZrX2 bekannt. Dazu kommen noch die Chloride, Bromide und Iodide der Form ZrX. Am stabilsten sind dabei die Tetrahalogenide der Form ZrX4. Von keinem der Zirconiumhalogenide sind wichtige Anwendungsbereiche bekannt, wobei Zirconiumchloride als Zwischenprodukte bei der Herstellung von reinem Zirconium entstehen.
Weitere Zirconiumverbindungen
Zirconiumsilicat, ZrSiO4, besser bekannt unter dem Mineralnamen Zirkon, ist die in der Natur häufigste Zirconium-Verbindung. Es stellt die wichtigste Quelle für Zirconium und seine Verbindungen dar. Daneben wird Zirkon als Schmuckstein verwendet.
Organische Zirconiumverbindungen sind meist instabil. Von Bedeutung sind vor allem organische Zirconiumkomplexe, sog. Zirconocene, mit Resten wie Cyclopentadienyl. Sie sind technisch wichtig als Katalysator bei der Polymerisation von Alkenen, insbesondere für die Herstellung von Polypropylen. Eine weitere Anwendung einer organischen Zirconium-Verbindung besteht in der Hydrozirconierung. Dabei werden Alkene mit Hilfe des Schwartz-Reagenzes Cp2ZrHCl (Cp = Cyclopentadienyl) in Alkohole oder Halogenkohlenwasserstoffe überführt. Bei der Reaktion von terminalen Alkinen mit dem Schwartz-Reagenz entstehen bei der Hydrozirconierung trisubstituierte Doppelbindungen, die weitere Umsetzung mit einem elektrophilen Reagenz führt zu trans-funktionalisierten Alkenen in hoher stereochemischer Reinheit.
Aluminium–Zirconium-Komplexe können als Antitranspirant verwendet werden.
Kaliumhexafluoridozirconat(IV) K2ZrF6 (CAS: 16923-95-8) kann zur Trennung von Zirconium von Hafnium eingesetzt werden.
Zirconiumcarbonat liegt als basischer Komplex vor. Es wird unter anderem in der Papierindustrie verwendet.
Zirkoniumsalze werden – neben aluminiumhaltigen Alaunen – bei der „Weißgerbung“ von Fellen eingesetzt.
Blei-Zirkonat-Titanat-Keramiken (PZT-Keramiken) werden für Piezoelemente verwendet.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 22.11. 2022