Halogenkohlenwasserstoffe
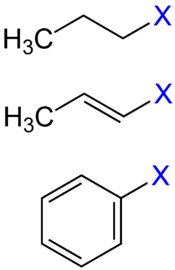
Als Halogenkohlenwasserstoffe oder halogenierte Kohlenwasserstoffe werden Kohlenwasserstoffe bezeichnet, bei denen mindestens ein Wasserstoffatom durch eines der Halogene Fluor, Chlor, Brom oder Iod ersetzt wurde. In der organischen Chemie werden einfach halogenierte Kohlenwasserstoffe mit R–X abgekürzt, wobei R für einen Kohlenwasserstoffrest und X für ein Halogenatom steht.
Eigenschaften und Risiken
Halogenkohlenwasserstoffe sind lipophile (fettlösliche) Substanzen, die vielfach hervorragende organische Lösungsmittel sind.
Sie besitzen meist eine höhere Siedetemperatur als die entsprechenden Kohlenwasserstoffe, da ihre Moleküle aufgrund zunehmender Van-der-Waals-Kräfte stärker miteinander wechselwirken. Dies beruht vor allem auf der besseren Polarisierbarkeit von Halogenen gegenüber Wasserstoff, die innerhalb der Halogengruppe von oben nach unten zunimmt. So sind Fluor- und Chlormethan bei Raumtemperatur gasförmig, Iodmethan flüssig, das komplett halogenierte Tetraiodmethan liegt bereits als Feststoff vor.
Eine Besonderheit stellen fluorierte Kohlenwasserstoffe dar, bei denen sich der Siedepunkt mit zunehmendem Fluorierungsgrad sogar verringern kann. Hier spielen Dispersionskräfte aufgrund der schlechten Polarisierbarkeit des Fluors eine wesentlich geringere Rolle. An ihre Stelle treten deutlich schwächere Dipol-Dipol-Kräfte, die durch die hohe Elektronegativitätsdifferenz zwischen Fluor und Kohlenstoff zustande kommen und stark von der Molekülgeometrie abhängig sind. Perfluorierte Kohlenwasserstoffe besitzen durch den symmetrischen Molekülaufbau kein elektrisches Dipolmoment. Die intermolekularen Wechselwirkungen sind bei diesen Verbindungen so schwach, dass sie als hochwertige Gleit- und Antihaftbeschichtungen eingesetzt werden, etwa auf schmutzabweisender Kleidung oder Kochgeschirr.
Halogenkohlenwasserstoffe kommen als wirksame Gifte, etwa in Insektiziden, zum Einsatz. Einige Verbindungen stehen im Verdacht, krebserregend zu sein. Auch Verbindungen von geringer akuter Toxizität rufen Spätfolgen hervor, da sie häufig schwer abbaubar sind und sich durch ihren lipophilen Charakter in der Fettschicht von Mensch und Tier anreichern. Bestimmte Halogenkohlenwasserstoffe wie DDT und seine Abbauprodukte DDE, DDD und Chlordan scheinen auch durch Ähnlichkeit mit Steroiden in das Hormonsystem höherer Tiere einzugreifen. So wurden bei Fischen und Amphibien Geschlechtsumwandlungen entdeckt. Halogenkohlenwasserstoffe werden außerdem teilweise für den Abbau der Ozonschicht verantwortlich gemacht.
Darstellung und Vorkommen
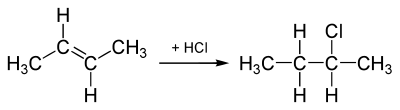
Durch nukleophile oder radikalische Substitution bzw. durch Additionsreaktionen kann ein Halogen-Atom in eine Kohlenwasserstoffverbindung eingebaut werden:
Die Halogenkohlenwasserstoffe werden zum größten Teil künstlich hergestellt. Es existieren jedoch auch viele natürliche halogenierte Kohlenwasserstoffe (ca. 3.800 sind bekannt), wie zum Beispiel Chlormethan.
siehe auch:
Einteilung
Aliphatische Halogenkohlenwasserstoffe
Die bei aliphatischen Halogenkohlenwasserstoffen verwendeten Halogene sind meist Fluor und Chlor. Man unterscheidet zwischen vollhalogenierten Kohlenwasserstoffen (Fluorchlorkohlenwasserstoffe, FCKW) und teilhalogenierten Kohlenwasserstoffen (H-FCKW).
Halogenalkane
Halogenalkane, auch Alkylhalogenide genannt, leiten sich von der Gruppe der Alkane ab. Sie bestehen aus gesättigten Kohlenwasserstoffmolekülen, bei denen ein oder mehrere Wasserstoffatome durch Elemente der 7. Hauptgruppe (Halogene) des Periodensystems ersetzt wurden.
Halogenalkane sind oft hervorragende Lösungsmittel für Stoffe, welche sich im Wasser nicht lösen. Außerdem können sie zur Entfettung von Metalloberflächen in der Metallverarbeitung genutzt werden.
In der chemischen Industrie werden sie als Ausgangsstoff zur Herstellung von diversen anderen Produkten verwendet. Dies beruht darauf, dass Halogenide oft gute Abgangsgruppen bei SN1- oder SN2-Substitutionen sind. Halogenalkane dienen auch zur Herstellung von Ethern aus Alkoholaten (Williamsonsche Ethersynthese).
Einige Halogenalkane sind krebserregend, oder stehen im Verdacht, krebserregend zu sein. Bei starker akuter wie auch bei chronischer Exposition rufen sie auch schwere Organschäden an Leber und Niere hervor. Zu diesen zählen besonders das 1,2-Dichlorethan, das Tetrachlormethan, das Chloroform, das Dichlormethan, sowie Halogenalkane, die gute Alkylierungsmittel sind, wie zum Beispiel das Iodmethan.
Mehrfach halogenierte Alkane dürfen keinesfalls mit Alkalimetallen oder stark basischen Trocknungsmitteln behandelt werden, da es zu spontaner, explosionsartiger Zersetzung kommen kann.
-3.jpg)
Wichtige Halogenalkane:
- Chloroform (CHCl3) früher als Narkosemittel, heute als Lösungsmittel
- Tetrachlormethan (CCl4) als Lösungsmittel und früher auch als Feuerlöschmittel
- Hexachlorethan (C2Cl6) jahrelang als chlortragender Feststoff an Stelle von Risiken bergendem Chlorgas zur Raffination von primärem, aus der Elektrolyse entnommenem Metall, aber auch im Gießereibereich zur Wasserstoffentfernung und Ausspülung von in der Schmelze suspendierten Oxiden eingesetzt
- Trichlorfluormethan, FCKW (CCl3F) als Treibgas bzw. Kältemittel
- Halothan (C2HBrClF3) als Inhalationsnarkotikum
- Chlorparaffine, die als Flammschutzmittel und Weichmacher verwendet werden
- Hexachlorcyclohexane (C6H6Cl6), zu denen das bekannte Insektizid Lindan gehört
Halogenalkene
Halogenalkene leiten sich von der Gruppe der Alkene ab. Sie bestehen aus ungesättigten Kohlenwasserstoffmolekülen, bei denen ein oder mehrere Wasserstoffatome durch Elemente der 7. Hauptgruppe (Halogene) des Periodensystems ersetzt wurden.
Sie besitzen trotz ihrer teilweisen Giftigkeit vielfältige Einsatzmöglichkeiten in der chemischen Industrie, vor Allem bei der Herstellung von Kunst- und Arzneistoffen.
Wichtige Halogenalkene:
- Vinylchlorid ist die Ausgangssubstanz zur Herstellung von PVC
- 1,1-Dichlorethen wird zum Polyvinylidenchlorid (PVdC) verarbeitet
- 1,1-Difluorethen ergibt bei der Polymerisation den Kunststoff Polyvinylidenfluorid
- Chloropren, Ausgangsstoff für das Elastomer Polychloropren
- Tetrafluorethylen ist Ausgangsstoff für Polytetrafluorethylen
Aromatische Halogenkohlenwasserstoffe
Halogenaromaten (auch Halogenarene) leiten sich von der Gruppe der Aromaten oder Arene ab, bei denen ein oder mehrere Wasserstoffatome durch Elemente der 7. Hauptgruppe (Halogene) des Periodensystems ersetzt wurden. Die meisten aromatischen Halogenverbindungen sind hochgiftig und werden oder wurden als Insektizide oder Fungizide eingesetzt. Viele davon sind mittlerweile verboten.
Verwendung
Von Methan und Ethan leiten sich eine Reihe von Halogenalkanen ab, die in Technik und Alltag vielfältig Verwendung finden. Chloralkane sind gebräuchliche Lösungsmittel für Fette und Harze: Dichlormethan und Trichlormethan (Chloroform) werden beispielsweise zum Extrahieren pflanzlicher Öle und zum Entfetten von Metallteilen verwendet. Trichlorethan wurde bei der „chemischen Reinigung“ als Kleiderbad eingesetzt.
Die mengenmäßig wichtigsten Halogenkohlenwasserstoffe sind die Chlorkohlenwasserstoffe (CKW), Fluorkohlenwasserstoffe (FKW) und die Fluorchlorkohlenwasserstoffe (FCKW). Zunehmend werden Bromkohlenwasserstoffe als Flammschutzmittel verwendet. Viele Halogenkohlenwasserstoffe wirken als ozonabbauende Verbindungen und/oder als Treibhausgase. Die Verwendungsbereiche für Halogenkohlenwasserstoffe in der nachfolgenden Auflistung sind heute weitgehend verboten oder durch Restriktionen und zeitlich begrenzte Verwendungszulassung stark eingeschränkt worden.

- Feuerlöschmittel
- Die in Feuerlöschern
und automatischen Löschanlagen
verwendeten Halogenkohlenwasserstoffe nennt man Halone. Da sie im hohen Maß
die Ozonschicht angreifen,
ist die Produktion von Halonen weltweit seit dem 1. Januar 1994 verboten. Für
die Entwicklungsländer gilt eine längere Ausstiegsfrist. Für teilhalogenierte
Fluor-Brom-Kohlenwasserstoffe (HFBKW) war das Ausstiegsdatum der 1. Januar
1996. Seit dem Jahr 2000 dürfen in Europa
Halone nur in solchen Anwendungsbereichen verwendet werden, die im Anhang VII
der Verordnung (EG) Nr. 2037/2000
als kritische Verwendungszwecke aufgelistet und damit zugelassen sind, wie zum
Beispiel in der Zivilluftfahrt als gewichtsparendes Löschmittel, welches in
Frachtern bzw. Frachträumen eingesetzt, und in Handfeuerlöschern
mitgeführt wird. In der militärischen Luftfahrt sowie in der zivilen
wird es
weiterhin als Löschmittel für Triebwerksschächte und Triebwerke eingesetzt und
ist zum Beispiel im Feuerlöschsystem (Fire Extinguisher
System) der F/A-18
anzutreffen. Beispiele:
- Halon 1211 (Verwendung in Handfeuerlöschern, Bromchlordifluormethan, CF2ClBr)
- Halon 1301 (Verwendung in automatischen Löschanlagen, Bromtrifluormethan>, CBrF3)
- Kältemittel
- Halogenkohlenwasserstoffe eignen sich auf Grund ihrer Eigenschaften hervorragend als Kältemittel, jede Inbetriebnahme oder Außerbetriebnahme, von Anlagen die mehr als drei Kilogramm ozonschichtabbauende oder in der Luft stabile Kältemittel enthalten, muss vom Inhaber der zuständigen Behörde gemeldet werden. Auch bereits im Betrieb stehende Anlagen sind in vielen EU-Ländern meldepflichtig.
- Lösungsmittel
- Halogenierte Kohlenwasserstoffe sind weitgehend unpolare Stoffe und daher gute Fettlösungsmittel. Hohe Dosen bzw. ständige Belastungen können zu Gesundheitsschäden führen.
- Pestizide
- Halogenkohlenwasserstoffe werden auch im Pflanzenschutz eingesetzt. Vor allem Chlorkohlenwasserstoffe (z.B. DDT) finden bzw. fanden ihre Verwendung im Bereich der Insektizide.
- Schmelzebehandlungsmittel
- Halogenkohlenwasserstoffe wurden als Ersatz für die risikobehaftete Anwendung von Chlorgas zwischen 1930 und 1990 zur Entfernung von Wasserstoff und flotierenden Oxiden bei der Schmelzebehandlung von Aluminium und seinen Legierungen in erheblichen Mengen eingesetzt. Danach wurde die Verwendung eingeschränkt bzw. wegen vermuteter Nähe zu Abbauprodukten ähnlich dem Seveso-Dioxin verboten.
- Treibgaskomponente in Sprühdosen
- Wichtige Treibmittel sind Trichlorfluormethan CCl3F und Dichlordifluormethan CCl2F2; beide Substanzen gelten als physiologisch unbedenklich. Es wurde allerdings herausgefunden, dass sie zum Abbau der Ozonschicht beitragen, da in der Stratosphäre Chlorradikale freigesetzt werden, die das Ozon in einer Reihe von Reaktionen zersetzen. Deshalb ist die Anwendung als Treibmittel in Sprühdosen aus ökologischen Gründen heute nicht mehr gebräuchlich.
Markennamen und ihre Notation
Freon ist der Markenname von DuPont, Frigen der von Hoechst und Solkane der von Solvay verwendete Name.
Analog zur Halon-Notation gilt die folgende Bezeichnungsweise für Freon, Frigen und Solkane:
- R DKHF
- [D] steht für das Vorhandensein der Doppelbindungen (0-keine Doppelbindung, 1-eine oder mehrere Doppelbindungen existieren)
- [K] steht für die Anzahl der Kohlenstoff-Atome, um eins erniedrigt
- [H] steht für die Anzahl der Wasserstoff-Atome, um eins erhöht
- [F] steht für die Anzahl der Fluor-Atome
- [R] stammt vom englischen Wort für Kältemittel (Refrigerant)
Wird der Stoff nicht als Kältemittel sondern z.B. als Treibmittel verwendet, wurde das R oft durch den Markennamen ersetzt.
Um von der Marken-Bezeichnung auf die Formel zu schließen, kann man folgendermaßen vorgehen: Man muss zu der Marken-Nummer die Zahl 90 hinzuzählen. In der daraus sich ergebenden Summe steht die erste Zahl für die Zahl der C-Atome, die zweite Zahl für die Zahl der H-Atome, die dritte Zahl für die Zahl der F-Atome. Die restlichen Bindungsplätze sind mit Cl-Atomen abgesättigt.
Beispiele:
- R22: 22 + 90 = 112 → 1 C-Atom, 1 H-Atom, 2 F-Atome, 1 Cl-Atom → CHClF2
- R134a (chlorfrei, aber starkes Treibhausgas): 134 + 90 = 224 → 2 C-Atome, 2 H-Atome, 4 F-Atome → C2H2F4; „a“ heißt in diesem Zusammenhang, dass 3 Fluor an einem C gebunden sind.
- R14 (Chlor- und Wasserstofffrei): 14 + 90 = 104 → 1 C-Atome, 4 F-Atome → CF4
Hat eine der Zahlen den Wert Null, wird sie bei vorgestellten Werten weggelassen. Die restlichen Bindungsplätze an den Kohlenstoffatomen sind durch Chloratome besetzt.
Beispielsweise für R11, CCl3F:
- Es ist keine Doppelbindung vorhanden, also ist D=0.
- Ferner ist die Anzahl der Kohlenstoffatome um eins erniedrigt (=K) auch 0.
- H=1, da kein Wasserstoffatom=0 um eins erhöht 1 ergibt.
- F=1 ist die Anzahl der Fluoratome im Molekül.
Also lautet die Bezeichnung: R11.
Sie haben üblicherweise ein (K=0) oder zwei (K=1) Kohlenstoffatome. Falls K größer ist als 1, liegt kein Reinstoff, sondern eine Mischung von Stoffen vor. Die Zusammensetzung einer solchen Mischung geht nicht direkt aus der Ziffernfolge hervor. Beispielsweise ist R502 eine Mischung aus R22 und R115 zu etwa gleichen Teilen.
Freon®, Frigen® oder Solkane® mit anderen Halogenen: Wenn der Stoff noch ein anderes Halogen als Fluor und Chlor enthält, wird seine Abkürzung, ein Buchstabe, und die Zahl der Atome angefügt wie z.B. bei R13B1.
- R13B1: 13 + 90 = 103 + 1 Bromatom → 1 C-Atom, 0 H-Atom, 3 F-Atome, 1 Br-Atom → CBrF3
Halon-Notation
Als Halone werden Methan- oder Ethan-Derivate bezeichnet die neben Fluor oder Chlor auch Brom enthalten. Halon(e) ist kein Markenname sondern eine Abkürzung für Halogenkohlenwasserstoff(e).
Analog zur Freon-, Frigen- und Solkane-Notation gilt die folgende Bezeichnungsweise für Halone:
- R KFCB
- [R] stammt vom englischen Wort für Kältemittel (Refrigerant).
- [K] steht für die Anzahl der Kohlenstoff-Atome
- [F] steht für die Anzahl der Fluor-Atome
- [C] steht für die Anzahl der Chlor-Atome
- [B] steht für die Anzahl der Brom-Atome
Wenn das Halon nicht als Kältemittel verwendet wird, wird das „R“ im Namen oft durch das Wort „Halon“ ersetzt.
Beispiele:
- R 1111 = CHFClBr
- R 1301 = BrCF3 (Bromtrifluormethan, Freon FE 13B1, R 13 B1)


© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 24.05. 2025