Flusssäure
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| MAK | 1 ml/m3 | |||||||
Flusssäure, auch Fluorwasserstoffsäure genannt (zur Namensgebung siehe Fluorit), ist die wässrige Lösung von Fluorwasserstoff (HF). Flusssäure ist eine farblose, stechend riechende, hochgiftige Flüssigkeit. Sie greift selbst Glas stark an und wirkt stark ätzend auf die Haut, die Schleimhäute und die Bindehaut der Augen, wobei schon eine geringe Exposition (bspw. durch dermale Aufnahme) schnell zum Tod führen kann. Eine Lösung von 38,2 % HF in Wasser bildet ein azeotrop siedendes Gemisch mit einem Siedepunkt von 112 °C. Flusssäure wird, abhängig von der Konzentration, entweder in Behältern aus Kunststoff oder aus rostfreiem Stahl aufbewahrt.
| Allgemeines | ||
|---|---|---|
| Name | Flusssäure | |
| Andere Namen |
Fluorwasserstoffsäure | |
| Summenformel | HF (aq) | |
| Kurzbeschreibung | farblose Flüssigkeit | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| DrugBank | ||
| Eigenschaften | ||
| Molare Masse | 20,01 g/mol | |
| Aggregatzustand | flüssig | |
| Dichte | 1,14 g/cm3 (38 %, Azeotrop) | |
| Schmelzpunkt | −44 °C (38–40 %) | |
| Siedepunkt | 112 °C (38 %) | |
| Löslichkeit | mischbar mit Wasser | |
Herstellung
Getrocknetes Fluoritpulver und Schwefelsäure werden zur Reaktion in den Drehrohrofen gegeben. Die Temperatur der Ofengasphase wird auf etwa 280 °C geregelt. Das Nachreaktionsgas tritt in den Rohdestillationsturm ein, um den größten Teil der Schwefelsäure, des Wassers und des Fluoritpulvers zu entfernen. Die Temperatur des Turmkessels wird auf 100 bis 110 °C geregelt und die Kopftemperatur beträgt 35 bis 40 °C. Das rohe Fluorwasserstoffgas wird durch einen Entgasungsturm weiter in einen flüssigen Zustand kondensiert und tritt dann in den Rektifikationsturm zur Rektifikation ein. Der gereinigte Fluorwasserstoff wird von Wasser absorbiert, so dass Flusssäure erhalten wird. Die Reaktionsgleichung lautet:
Das Nebenprodukt Fluoroanhydrit findet in der Baustoffindustrie Verwendung.
Flusssäure fällt auch bei der Produktion von Phosphorsäure aus Fluorapatit an, wobei der Reaktionsgang analog zum oben dargestellten ist, jedoch unter Beteiligung von Phosphat. Der hierbei analog anfallende Phosphorgips ist jedoch zumeist zu verunreinigt, um wirtschaftlich nutzbar zu sein.
Eigenschaften
Fluorwasserstoff ist im Vergleich zu den anderen Halogenwasserstoffen eine schwache Säure (pKs = 3,14). Flusssäure greift Gold und Platin nicht an, jedoch werden Tantal, Silber, Kupfer und Blei schwach angegriffen. Flusssäure ist die einzige Säure, die Quarz unter Bildung von Siliciumtetrafluorid oder Hexafluoridokieselsäure aufzulösen vermag.
Verwendung
Für Flusssäure gibt es zahlreiche Verwendungszwecke in Industrie und Wissenschaft. Die industrielle Gesamtproduktion in Europa betrug im Jahre 2015 über 230.000 Tonnen. Diese wurden in neun Produktionsstätten hergestellt. Fünf davon stehen in Deutschland.
Industrielle Verwendung
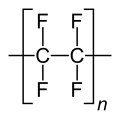
Polytetrafluorethylen (Teflon)
- Fluorchlorkohlenwasserstoffe (FCKW) werden vor allem in der Kältetechnik und zur Verschäumung von Kunststoffen benutzt.
- 60 % der Flusssäure werden für die Herstellung von Fluorkohlenstoffen (FK) benötigt.
- Fluorpolymere sind Kunststoffe, die sich durch ihre besondere Stabilität auszeichnen. Der bekannteste davon ist PTFE (Teflon).
- Metallgewinnung und -verarbeitung. Flusssäure ist dort z.B. ein Reaktionsprodukt, um Aluminiumfluorid herzustellen oder wird bei der Gewinnung seltener Metalle wie Niob oder Tantal und bei der Oberflächenbehandlung von rostfreiem Edelstahl eingesetzt.
- Ansonsten kommt Flusssäure in der Erdölindustrie als Katalysator, in geringen Maße in der Arzneimittel- und Pflanzenschutzmittelherstellung, zum Einsatz.
- Darüber hinaus wird die glasätzende Wirkung bei der Herstellung von Kristallglas zur Oberflächenpolierung genutzt.
Forschung und Wissenschaft

Eierbecherstruktur
In der Forschung ist Flusssäure unter anderem ein Ätzmittel für Siliciumdioxid, Titan, Niob, Tantal oder Wolfram, z.B. in der Mikrostrukturierung von Oberflächen. Dort wird häufig eine mit Ammoniumfluorid gepufferte Flusssäure verwendet, um den Ablauf des Ätzprozess besser steuern zu können. Daneben wird die Fähigkeit Silicate zu lösen bei Aufschlussverfahren in der Analytik eingesetzt.
In der Paläontologie und Pollenkunde wird HF zum Freilegen von unempfindlichen Fossilien oder von Exinen benutzt.
Sonstige Verwendung
Eine 10 % wässrige Fluorwasserstofflösung findet Verwendung als Rostentferner für Textilien.
Flusssäure wird auch zum „Etching“, dem Zerkratzen von Glasscheiben, häufig an Einrichtungen des Öffentlichen Personenverkehrs, verwendet. Dabei kann es zu schweren Verletzungen der Haut und der Atemwege kommen, wenn Fahrgäste oder das Reinigungspersonal mit der Flüssigkeit in Berührung kommen.
Toxikologie
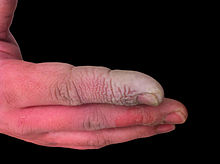
Flusssäure zeigt, je nach Exposition, nur lokale oder auch systemische Wirkung. Bei Konzentrationen über etwa 50 % treten Verätzungen des Gewebes auf. Aber auch niedrigere Konzentrationen können schwere Gewebeschäden verursachen. Da Flusssäure lipophil ist, kann sie die Haut durchdringen. In der Tiefe des Gewebes bildet es schwer lösliches Calcium- und Magnesiumfluorid, die dadurch verursachte Störung des Elektrolythaushaltes schädigt Zellen und führt zu starken Schmerzen. Bei starker Exposition (Konzentration über 50 %, Exposition von mehr als 5 % der Körperoberfläche), Einatmen oder Verschlucken führt diese Störung auch zu systemischen Effekten wie Übelkeit, Erbrechen, Krämpfen, niedrigem Blutdruck, Herzrhythmusstörungen bis zu Herzstillstand. Die Symptome können insbesondere bei Kontakt mit niedrigkonzentrierter Flusssäure erst etliche Stunden später auftreten. Es wird davon ausgegangen, dass Fluorid-Ionen auch direkt toxisch für Herzmuskelzellen sind.
Aufgrund der Seltenheit von Unfällen mit Flusssäure fehlen große systematische Untersuchungen zur Behandlung. Bei Kontakt mit der Haut sollte diese gründlich mit Wasser gespült und anschließenden mit Calciumgluconatgel eingerieben werden. Eine Unterspritzung mit Calciumgluconatlösung ist in der Literatur umstritten, ebenso die intraarterielle Gabe von Calciumgluconat zur Neutralisation der Flusssäure. Bei starker Exposition kann die chirurgische Entfernung des Gewebes notwendig sein. Eine Verätzung der Augen wird ebenfalls durch Spülen mit Wasser und anschließend Calciumgluconatlösung behandelt. Bei Inhalation soll Sauerstoff und vernebelte Calciumgluconatlösung gegeben werden. Systemische Störungen des Elektrolythaushalts werden durch Infusionen mit Calciumgluconatlösung sowie Dialyse behandelt.
Weblinks
- Schweizerisches Toxikologisches Informationszentrum: Verätzungen und Vergiftungen durch Flusssäure


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 25.06. 2024

