
Calciumchlorid
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| Toxikologische Daten | 1000 mg/kg (LD50, Ratte, oral) | ||||||||
Calciumchlorid (auch Kalziumchlorid) ist ein Chlorid des Erdalkalimetalls Calcium mit der Verhältnisformel CaCl2. Calcium liegt dabei in der Oxidationsstufe +2 vor, Chlor hat die Oxidationsstufe −1.
Geschichte
Um 1860 gelang den Chemikern Robert Wilhelm Bunsen und Augustus Matthiessen die erste Reindarstellung des Elementes Calcium durch Schmelzelektrolyse von Calciumchlorid.
Vorkommen
Calciumchlorid kommt in der Natur gelöst in Salzsolen vor.
Wasserhaltiges Calciumchlorid bildet die seltenen Minerale Sinjarit (Dihydrat) und Antarcticit (Hexahydrat). Das Anhydrid kommt als Hydrophilit vor.
Gewinnung und Darstellung
Calciumchlorid wird aus Salzsäure und Calciumcarbonat hergestellt:
Anschließendes Erhitzen auf 260 °C liefert die wasserfreie Form.
Technisch wird Calciumchlorid als Abfallprodukt bei der Sodaherstellung nach dem Solvay-Verfahren – und zwar bei der Rückgewinnung des Ammoniaks aus dem dabei entstandenen Ammoniumchlorid – erhalten:
| Kristallstruktur | |
|---|---|
 | |
| __ Ca2+ __ Cl− | |
| Allgemeines | |
| Name | Calciumchlorid |
| Andere Namen |
|
| Verhältnisformel | CaCl2 |
| Kurzbeschreibung | farb- und geruchlose, hygroskopische Kristalle |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer |
|
| ECHA-InfoCard | 100.030.115 |
| PubChem | 5284359 |
| DrugBank | DB01164 |
| Arzneistoffangaben | |
| ATC-Code |
|
| Eigenschaften | |
| Molare Masse |
|
| Aggregatzustand | fest |
| Dichte |
|
| Schmelzpunkt |
|
| Siedepunkt | 1670 °C |
| Löslichkeit | gut in Wasser (740 g/l−1 bei 20 °C) |
Eigenschaften
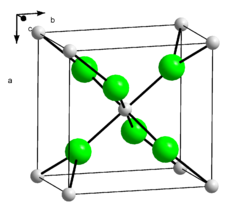
Calciumchlorid ist ein Salz. Calcium und Chlor liegen aufgrund des großen Elektronegativitätsunterschiedes ionisch vor. Die Bindung erfolgt somit über elektrostatische Wechselwirkungen. Calciumchlorid bildet farblose Kristalle, die eine verzerrte Rutil-Struktur ausbilden (orthorhombisch, Raumgruppe Pnnm (Raumgruppen-Nr. 58).
Calciumchlorid bildet in Reinform farblose Kristalle und ist in wasserfreiem Zustand stark hygroskopisch. Es nimmt leicht Wasser aus der Umgebung auf und bildet dabei einen Hydrat-Komplex. Es sind mehrere kristalline Hydrate bekannt. Das Dihydrat kristallisiert orthorhombisch in der Raumgruppe Pbcn (Raumgruppen-Nr. 60) mit den Gitterparametern a = 5,893 Å, b = 7,469 Å und c = 12,07 Å. Das Tetrahydrat ist polymorph. Die α-Form kristallisiert triklin, Raumgruppe P1 (Nr. 2), mit den Gitterparametern a = 6,593 Å, b = 6,367 Å, c = 8,561 Å, α = 97,83°, β = 93,5° und γ = 110,6°. Die β-Form hat eine monokline Struktur mit der Raumgruppe P21/c (Nr. 14), Gitterparameter a =8,923 Å, b = 10,22 Å, c = 12,79 Å und β = 114,7°. Die γ-Form des Tetrahydrats kristallisiert ebenfalls monoklin in der Raumgruppe P21/c (Nr. 14) mit den Gitterparametern a = 6,139 Å, b = 7,667 Å, c = 8,901 Å und β = 111,0°. Das Hexahydrat hat eine trigonale Struktur, Raumgruppe P321 (Nr. 150) mit den Gitterparametern a = 7,876 Å und c = 8,561 Å. Es sind auch entsprechende Komplexe mit Ammoniak bekannt (CaCl2·n (NH3) mit n=1,2,4,8).
Das wasserfreie Calciumchlorid löst sich in Wasser exotherm.
Die Verbindung bildet mit Methanol und Ethanol bei Raumtemperatur stabile Solvate. Mit Methanol wurden Solvate der Stöchiometrie 1:2, 1:3, 1:4, 1:6 und 1:8 bezogen auf Calciumchlorid und mit Ethanol Solvate der Stöchiometrie 1:2, 1:3, 1:4 und 1:6 bezogen auf Calciumchlorid hergestellt und charakterisiert.
Reaktionen

Calciumchlorid reagiert mit Wasser unter Bildung
eines Hexahydrat-Komplexes und starker Wärmeentwicklung
Die Kristalle des Hexahydrats lösen sich bei ungefähr 30 °C im eigenen Kristallwasser. Erhitzen auf ungefähr 200 °C setzt das gebundene Wasser wieder frei. Das Auflösen in Wasser führt im Gegensatz zu wasserfreiem Calciumchlorid zu einer starken Abkühlung. Beide Calciumchlorid-Formen sind zudem gut löslich in Ethanol.
Verwendung

Wasserfreies Calciumchlorid ist aufgrund seiner Hygroskopie ein wichtiges Trocknungsmittel im Labor, beispielsweise im Exsikkator, und in der technischen Chemie für Gase und Flüssigkeiten.
Darüber hinaus wird es als Streusalz (Auftaumittel) sowie als Hexahydrat zur Herstellung von Kältemischungen verwendet.
Anwendungsfelder im Bauwesen sind die rocknung von Wohnräumen, der Einsatz als Frostschutzmittel, im Speziellen als Frostschutzmittel und Abbindebeschleuniger im Beton, sowie als Staubbindemittel (zum Beispiel auf Baustellen und als Besatz bei Sprengarbeiten). Die Verwendung von Calciumchlorid als Abbindebeschleuniger in Beton wurde in Deutschland wegen der korrosiven Wirkung des Chlorids auf die Eisenarmierung 1963 verboten.
Dem Füllwasser von betonierten Schwimmbecken wird Calciumchlorid zugesetzt, um die Wasserhärte zu erhöhen und nach dem Prinzip vom kleinsten Zwang die Betonerosion durch Lösung von Calciumverbindungen aus dem Beton zu reduzieren.
Außer als Frostschutzmittel wird die größte Menge Calciumchlorid zum Binden von Sand und Staub auf unbefestigten Straßen eingesetzt. Da es stark hygroskopisch ist, zieht eine auf der Straße aufgebrachte konzentrierte Calciumchloridlösung Feuchtigkeit an und unterdrückt den Abtrag des Straßenstaubs. Die Straßenoberfläche muss seltener eingeebnet und die Oberfläche seltener erneuert werden.
Die Lebensmittelindustrie verwendet es als Komplexbildner, Geschmacksverstärker und Stabilisator (unter anderem bei der Trinkwasseraufbereitung). Es ist in der Europäische Union als Lebensmittelzusatzstoff der Nummer E 509 zugelassen. Die tägliche Aufnahmemenge wird mit 160–345 mg angenommen.
Als Festigungsmittel wird es Dosengemüse und aufgeschnittenen Früchten zugesetzt. Ebenfalls dient es zur Gerinnung von Eiweißen in der Lebensmittelherstellung, zum Beispiel bei der Produktion von Käse, Tofu oder künstlichem Kaviar. Bei der Käseherstellung wird Calciumchlorid manchmal der Milch zugesetzt, um die Eigenschaften des ausgefällten Kaseins zu verbessern.
In Sportgetränken dient es als Elektrolyt.
Aufgrund des salzigen Geschmacks kann es Speisesalz in Salzgurken und Sauergemüse ersetzen.
Beim Bierbrauen wird Calciumchlorid verwendet, um den Mineraliengehalt des Brauwassers anzugleichen und Geschmack und Hefewachstum zu beeinflussen.
Calciumchlorid wird zur Oberflächenbehandlung von Obst eingesetzt. Äpfel werden in der späten Wachstumsphase behandelt, um die Mangelkrankheit Stippe und andere Beeinträchtigungen zu vermeiden.
Unter Ausnutzung der exothermen Hydratation bei der Reaktion mit Wasser findet Calciumchlorid Einsatz zur Erwärmung von Fertiggetränken.
In der Molekularbiologie dient es zur Herstellung kompetenter Zellen. Calciumionen verändern hierbei die Permeabilität der Zellmembran und steigern so das Aufnahmepotenzial der Zelle für DNS.
In der Meerwasseraquaristik wird Calciumchlorid genutzt, um den Calciumgehalt zu erhöhen.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 19.01. 2024
