Block des Periodensystems
Als Block im Periodensystem werden chemische Elemente nach den energiereichsten Atomorbitalen ihrer Elektronenhülle zusammengefasst. Ein Block fasst mehrere Gruppen des Periodensystems zusammen.
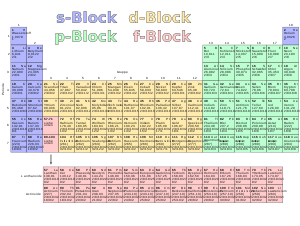
s-,
p-, d- und f-Block des Periodensystems
Man unterscheidet folgende Blöcke:
- s-Block: gegenüber dem vorhergehenden Element kommt ein Elektron in einem s-Orbital hinzu. Zu diesem Block gehören Wasserstoff, Helium sowie die Elemente der 1. und 2. Hauptgruppe (Alkalimetalle und Erdalkalimetalle).
- p-Block: gegenüber dem vorhergehenden Element kommt ein Elektron in einem p-Orbital hinzu. Zu diesem Block gehören alle anderen Hauptgruppenelemente, also die Erdmetalle, Kohlenstoffgruppe Stickstoffgruppe, Chalkogene, Halogene und Edelgase.
- d-Block: gegenüber dem vorhergehenden Element kommt ein Elektron in einem d-Orbital hinzu. Diese Elektronen befinden sich nicht in der äußersten Schale, sondern eine darunter (vgl. Elektronenkonfiguration, Aufbauprinzip). Da diese Elemente jeweils nur ein oder (meist) zwei Außenelektronen besitzen, zeigen sie ein ähnliches chemisches Verhalten. Zu diesem Block gehören alle Nebengruppenelemente.
- f-Block: gegenüber dem vorhergehenden Element kommt ein Elektron in einem f-Orbital hinzu. Auch diese Elektronen befinden sich nicht in der äußersten Schale, sondern in der drittäußersten. Die chemische Ähnlichkeit in diesem Block ist daher noch stärker ausgeprägt als im d-Block. Zum f-Block gehören die Lanthanoide und Actinoide.
- g-Block (im Erweiterten Periodensystem, rein hypothetisch): gegenüber dem vorhergehenden Element kommt ein Elektron in einem g-Orbital hinzu. Der g-Block ist ein Abschnitt der Superactinoide.
Siehe auch


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 13.03. 2022