
Edelgase
Als Edelgase werden die Elementeder 8. Hauptgruppe des Periodensystems bezeichnet (früher auch: Nullgruppe; nach der neueren Nummerierung der IUPAC: Gruppe 18). Es sind die Elemente: Helium, Neon, Argon, Krypton, Xenon, Radon sowie das künstlich erzeugte, ebenfalls radioaktive Oganesson.
| Gruppe | 18 |
| Hauptgruppe | 8 |
| Periode | |
| 1 | 2 He |
| 2 | 10
Ne |
| 3 | 18 Ar |
| 4 | 36 Kr |
| 5 | 54 Xe |
| 6 | 86 Rn |
| 7 | 118 Og |
Alle Edelgase sind farb- und geruchlose, nicht brennbare und kaum wasserlösliche Gase. Sie kommen nur atomar vor, d. h. nicht molekular, da sie chemisch nahezu keine Verbindungen eingehen können. Der Grund hierfür ist, dass die Energieniveaus (veraltet: "Schalen") des Atoms abgeschlossen - d.h. vollständig mit Elektronen aufgefüllt - sind (für ein genaueres Verständnis benötigt man die Quantenmechanik). Dennoch konnten einige wenige Edelgasverbindungen (wie z.B. XePtF6) und Einschlussverbindungen (Klathrate) erzeugt werden.
Geschichte

Nach der Entdeckung der zuvor unbekannten Heliumlinie im Spektrum des Sonnenlichtes durch Pierre Janssen wurden die Edelgase in den Jahren von 1894 bis 1905 von Sir William Ramsay isoliert - Helium zusammen mit John William Strutt, 3. Baron Rayleigh, Krypton, Neon und Xenon zusammen mit Morris William Travers. Ramsay erhielt dafür 1904 den Nobelpreis für Chemie. Die Reaktionsunfähigkeit dieser Gase trug wesentlich zu der Erkenntnis bei, dass sich die chemischen Eigenschaften der Elemente periodisch wiederholen. Dies war von Bedeutung für die Entwicklung des "Periodensystems der Elemente" und das Verständnis der Zusammenhänge zwischen dem Aufbau der Atome und den chemischen Eigenschaften der Elemente, aus denen sich die Materie unseres Universums zusammensetzt.
Für die Edelgase wurden auch zahlreiche Anwendungsmöglichkeiten in der Beleuchtungstechnik (z.B. Neonröhre), Schweißtechnik (als Schutzgas) und Raumfahrttechnik sowie als Traggas (Ballonfüllung) gefunden.
Vorkommen und Darstellung
Helium ist nach Wasserstoffdas zweithäufigste Element im Universum.
Auf der Erde sind Edelgase erheblich seltener, sie kommen von Natur aus in der Erdatmosphäre, also unserer Luftvor. Ihr Gehalt in der Luft beträgt:
| Argon | 0,934 | Vol.-% | = | 9,34 | l/m3 |
| Neon | 18,18 | ppm | = | 18,18 | ml/m3 |
| Helium | 5,24 | ppm | |||
| Krypton | 1,14 | ppm | |||
| Xenon | 0,087 | ppm | = | 87 | ppb |
| Radon | Spuren |
Das radioaktive Zerfallsprodukt Radon kommt nur in Spuren im ppt-Bereich (parts per trillion) von etwa 1000 Atomen pro Liter Bodenluft vor - insbesondere in einigen unterirdischen Stollen, Höhlen und unter anderem auch in Kellern.
Die Edelgase werden in "Luftzerlegungsanlagen (LZA)" und Niederdruck-Sauerstoff-Anlagen durch fraktionierte Destillation der Luft bzw. der Roh-Argon-Fraktion der LZA dargestellt (Luftverflüssigung). Aufgrund ihrer Seltenheit sind Krypton, Xenon und Neon wesentlich teurer als Argon und Helium.
Das meiste Helium wird aus Erdgasengewonnen, in dem es bis zu ca. 8 % vorhanden ist, vor allem amerikanische Quellen weisen einen hohen Heliumanteil auf. Bei der Abkühlung des Erdgases auf -205 °C bleibt nur Helium gasförmig zurück. Argon fällt zudem als Nebenprodukt bei der Ammoniak-Synthese an, da es sich mit ca. 10 % im Gasgemisch anreichert.
Eigenschaften
Der Name "Edelgas" kommt daher, dass diese Elemente der VIII. Hauptgruppe analog zu den Edelmetallen sehr reaktionsträge (inert) sind. Das liegt daran, dass die Außenschalen ihrer Atome mit der höchstmöglichen Elektronenanzahl besetzt sind. Das sind beim Helium zwei Elektronen - die erste Schale kann nicht mehr enthalten - und bei den anderen Edelgasen acht.
Diese so genannte Edelgaskonfiguration ist energetisch betrachtet in vielen Fällen als Idealzustand eines Atoms anzusehen. Das Bestreben, einen energetisch günstigeren Zustand anzustreben, kann als wesentliche Ursache für chemischen Reaktionen aufgeführt werden. Hierbei entstehen dann Moleküle oder Ionen. Vereinfacht gesagt, streben Atome häufig (aber nicht immer) eine Edelgaskonfiguration an. Allerdings ist der Sachverhalt in Wahrheit um einiges komplizierter. So gibt es eine Unzahl an chemischen Verbindungen, in denen nicht alle Atome die Edelgaskonfiguration besitzen, die aber trotzdem stabil sind, z.B.: Phosphorpentafluorid (PF5), Schwefelhexafluorid (SF6) oder die unten genannten Xenonfluoride. Darüber hinaus sind viele Ionen oder Moleküle, bei denen die Edelgaskonfiguration erreicht wird, thermodynamisch instabil, wie beispielsweise CO (Kohlenstoffmonoxid), N2O5 (Distickstoffpentoxid) oder selbst die bekannten Ionen O2− (Oxid) und N3− (Nitrid). Letztere kann man nur in Kombination mit Kationen als Salze isolieren. Die Gitterenergie dieser Salze kompensiert dabei die Energie, die aufgebracht werden muss, um diese Anionen zu erzeugen.
Im Unterschied zu allen anderen gasförmigen Elementen bzw. sämtlichen Nichtmetallen kommen die Edelgase daher in der Luft nicht molekular, sondern nur einatomig vor. Es gibt dennoch einige künstlich erzeugte Edelgasverbindungen. Isolierbare binäre (aus zwei Elementen bestehende) Verbindungen sind Xenonhexafluorid XeF6, Xenontetrafluorid XeF4, Xenondifluorid XeF2, Kryptondifluorid KrF2, Xenon(VI)-oxid XeO3, Xenon(VIII)-oxid XeO4. Die ersten Vertreter wurden Mitte der 60er Jahre des 20. Jahrhunderts synthetisiert. Viele sind weniger stabil als die elementaren Edelgase (z.B. KrF2 und die Xenonoxide). Die Fluoride des Xenons sind aber thermodynamisch stabil, das heißt, sie bilden sich freiwillig und unter Energiefreisetzung aus den Elementen Xenon und Fluor.
Chemische Eigenschaften
Trotz des Aufbaus der Edelgasatome sind die schweren Edelgase nicht völlig unreaktiv und können einige Verbindungen bilden. Verantwortlich hierfür sind der größere Abstand der Valenzelektronen vom Kern, wodurch die Ionisierungsenergie sinkt, sowie relativistische Effekte. Die größte Vielfalt an Verbindungen ist vom Xenon und nicht wie zu erwarten vom Radon bekannt, da bei diesem die starke Radioaktivität und kurze Halbwertszeit die Bildung von Verbindungen und deren Untersuchung erschwert.
Das einzige Element, das in der Lage ist, direkt mit Xenon, Radon und unter bestimmten Bedingungen auch Krypton zu reagieren, ist Fluor. Während das bei der Reaktion von Krypton und Fluor gebildete Krypton(II)-fluorid thermodynamisch instabil und daher nur bei tiefen Temperaturen synthetisierbar ist, sind die Xenon- und auch Radonfluoride auch bei Raumtemperatur stabil. Andere Elemente reagieren nicht mit Edelgasen, dennoch sind verschiedene weitere Verbindungen bekannt, die durch Reaktionen der Fluoride zugänglich sind.
Die Reaktivität und Stabilität von Verbindungen der leichten Edelgase Helium, Neon und Argon konnte mit Ausnahme einer bekannten Argonverbindung, HArF, nur theoretisch untersucht werden. Demnach gilt Neon als das am wenigsten reaktive Edelgas. So zeigte sich in Rechnungen, dass das Neonanalogon der einzigen in der Theorie stabilen Heliumverbindung HHeF nicht stabil sein sollte.
Aufgrund des Fehlens chemischer Verbindungen der Edelgase gab es lange Zeit auch keine Zahlenwerte ihrer Elektronegativitäten – bestimmt werden konnten davon bis jetzt nur die Werte der Pauling-Skala für die beiden Elemente Xenon (2,6) und Krypton (3,0), die damit in etwa denen der Halogene entsprechen. In den neueren Elektronegativitätsskalen nach Mulliken, Allred und Rochow dagegen lassen sich auch Zahlenwerte für die übrigen Edelgase berechnen, die in diesem Fall über die der Halogene hinausreichen. Bei Helium betragen sie beispielsweise 5,50 nach Allred-Rochow und 4,86 nach Mullikan.
Helium (He)

Helium ist - der geringen Atommasse entsprechend - das Edelgas mit dem niedrigsten Siedepunkt (4,22 K), der niedrigsten Dichte(0,1785 kg/m3) und der geringsten Wasserlöslichkeit. Es ist so leicht, dass es ständig aus der Erdatmosphäre in das All entweicht - jedoch wird vom Sonnenwind auch ständig Helium nachgeliefert.
Als einziger Stoff überhaupt wird Helium unter Normaldruck auch bei niedrigsten Temperaturen nicht fest, selbst nahe am absoluten Nullpunkt muss ein Druck von mindestens 24,5 bar angewendet werden, um flüssiges Helium zu verfestigen.
Flüssiges Helium wird nahe dem absoluten Nullpunkt "suprafluid". In diesem nur quantentheoretisch erklärbaren Zustand fließt es absolut reibungsfrei (Onnes-Effekt) in ca. 100 Atomschichten dicken Rollin-Filmen auch über Gefäßwände hinweg.
Benannt wurde Helium nach der Sonne (griech.: "helios"), da es bei der totalen Sonnenfinsternis von 1868 durch P. Janssen im Spektrum der Sonnenprotuberanzen entdeckt wurde (Spektralanalyse). Er hielt das so neu entdeckte Element für ein Metall (bis dahin waren Spektren nur bei Metallen gefunden worden), weshalb er dem Namen die für Metalle übliche Endung -ium anhüngte, während die anderen Edelgase später die Endung -on erhielten.
Erst 1895 konnte Helium auf der Erde isoliert werden (William Ramsay), indem man uran-und thoriumhaltige Mineralien im Vakuum erhitzte (Porzellanrohr, 1200 °C). 1917 konnte es dann auch durch Erdgas- und Luftverflüssigung gewonnen werden.
Schmelztemperatur: -272,2 °C bzw. 0,96 K (bei einem Druck von 24,5
bar)
Siedetemperatur: -269,0 °C bzw. 4,2 K
Neon (Ne)

Neon (Gehalt in der Luft ca. 16 ml/m3) ist nach Wasserstoffund Helium das drittleichteste aller Gase (Dichte0,8999 kg/m3 bei 273 K ). Es hat zwar eine höhere Atommasse als Stickstoff und Sauerstoff, jene kommen allerdings nur als Moleküle vor.
Es ist insbesondere aus der Beleuchtungstechnik bekannt, da es in Leuchtröhren scharlachrotes Licht emittiert. Es wird zunehmend aber auch als Kühlmittel in der Kältetechnik genutzt
Neon bedeutet das "Neue" (von griech. "neos",neu); es wurde für ein so einfaches chemisches Element relativ spät, erst 1898 von William Ramsay und Morris William Travers entdeckt.
Schmelztemperatur: -248,6 °C bzw. 24,6 K
Siedetemperatur:
-246,1 °C bzw. 27,1 K
Argon (Ar)

Argon, das häufigste (Luft enthält etwa 0,9 %) und daher preiswerteste Edelgas, hat mit 1,784 kg/m3 bei 273 K eine Dichte, die nur etwas über der von Stickstoffund Sauerstoff liegt, die mit 78 % beziehungsweise 21 % den Hauptanteil der Luft ausmachen.
Im Labor kann Argon daher - zusammen mit den restlichen Edelgasen - auch gewonnen werden, wenn mit Natronkalk getrocknete und von Kohlenstoffdioxid gereinigte Luft über glühendes Kupfergeleitet und danach mit Magnesium erhitzt wird, so dass der Sauerstoff als Kupfer(II)-oxid und der Stickstoff als Magnesiumnitrid Mg3N2 gebunden werden. Das Restgas (Rohargon) besteht zu 99,8 % aus Argon.
Argon kommt von dem altgriechischen Wort "argos", welches "träge" bedeutet und sich auf das Reaktionsverhalten dieses Edelgases bezieht. Es wurde 1894 von John William Strutt und William Ramsay entdeckt.
Schmelztemperatur: -189,4 °C bzw. 83,8 K
Siedetemperatur:
-185,9 °C bzw. 87,3 K
Krypton (Kr)
Krypton, das "Verborgene" (griech.: "kryptos"), ist bereits schwerer und somit auch leichter zu verflüssigen als Luft (Siedepunkt um 120 K, Dichte 3,749 kg/m3 bei 273 K). Nur 1,14 ml Krypton sind in 1 Kubikmeter Luft enthalten, jedoch reichert es sich als Spurengas ganz langsam in der Atmosphäre an (Nebenprodukt aus der Plutonium- und Uran-Spaltung), aus der es in Sauerstoffanlagen wieder als Kr-Xe-Konzentrat gewonnen wird (Lampen-Füllgas). Mithilfe von Fluorgasals dem stärksten aller Oxidationsmittel gelang es inzwischen, die chemische Verbindung Kryptondifluorid zu erzwingen (Redoxreaktion) - ein ätzendes, giftiges Gas, das in Kontakt mit Metallen sofort zu Krypton und Metallfluoriden zurückreagiert.
Krypton kommt vom altgriechischen Wort "kryptos", was "verborgen" bedeutet. Es wurde wie Neon 1898 von William Ramsay und Morris William Travers entdeckt.
Schmelztemperatur: -157,4 °C bzw. 115,8 K
Siedetemperatur:
-153,4 °C bzw. 119,8 K
Xenon (Xe)
Xenon ist eines der seltensten Elemente der Erde und fast vier mal so schwer wie Luft (Dichte 5,9 kg/m3 bei 273 K). Dadurch weist es eine derart niedrige Schallgeschwindigkeit auf, dass es die menschliche Stimme nach dem Einatmen eines Xenon-Sauerstoffgemisches (79 % Xe zu 21 % O2 wie in Luft) in sehr tiefem Bass erklingen läst.
Xenon wirkt außerdem in bestimmten Konzentrationsbereichen narkotisierend und wird derzeit als bessere Alternative zu bisherigen Narkosemitteln getestet, die immer noch mit Risiken verbunden sind.
Xenon ist neben dem radioaktiven Radon das einzige Edelgas, das thermodynamisch stabile Verbindungen eingeht (s.u.). Eine davon, das Xenondifluorid, wird sogar als (teures) starkes Oxidationsmittel bei der Synthese organischer Chemikalien eingesetzt.
Xenon kommt von dem altgriechischen Wort "xenos", was fremd bzw. unbekannt bedeutet. Es wurde ebenfalls 1898 durch William Ramsay und Morris William Travers entdeckt.
Schmelztemperatur: -111,8 °C bzw. 161,4 K
Siedetemperatur:
-108,1 °C bzw. 165,0 K
Radon (Rn)
Radon ist das schwerste elementare Gas in der Erdatmosphäre Dichte9,73 kg/m3 (273 K) und auch das seltenste elementare Gas überhaupt. In fester und flüssiger Form luminesziert es aufgrund seiner Radioaktivität. Auch die Zerfallsprodukte von Radon sind radioaktiv (Gesundheitsgefahr im Uranbergbau!), dennoch werden winzige Radonspuren bei der Radonbalneologie z.B. in Bad Gastein, Karlsbad und Ischia angewendet. Das langlebigste Isotop Radon-222 hat eine Halbwertszeit von 3,824 Tagen.
Der Name Radon wurde von Radium abgeleitet aus dem es ausgast, dessen Name leitet sich vom lateinischen Wort "radius" - Strahl ab; beide Elemente sind stark radioaktiv. Es wurde 1900 von Friedrich Ernst Dorn entdeckt, konnte aber erst 1908 von William Ramsay und Robert Whytlaw-Gray isoliert und näher bestimmt werden. Sie nannten das Element zuerst Niton nach dem lateinischen Wort "nitens" - leuchtend. Der Name Radon ist erst seit 1923 gebräuchlich.
Schmelztemperatur: -71,2 °C bzw. 202 K
Siedetemperatur: -62,2 °C
bzw. 211 K
Verwendung


Beleuchtungstechnik
Edelgase werden für Leuchtreklamen verwendet, da sie in Gasentladungsröhren charakteristische Farben ausstrahlen:
- Helium: rosa
- Neon: orange
- Argon: blau
- Krypton: gelbgrün
- Xenon: violett
- Radon: rot
Leuchtröhren oder Kaltkathodenlampen sind dünne, mit Gas unter geringem Druck gefüllte Glasrohre, deren Enden mit Elektroden verschlossen sind. Beim Anlegen einer hohen Spannung werden die Atome ionisiert und zum Leuchten angeregt. Da die Leuchtröhre, anders als eine Leuchtstofflampe, mit ungeheizten Elektroden arbeitet, benötigt sie hohe Betriebs-Spannungen von 400 V (bei ca. 30 mm Durchmesser) bis 1000 Volt (bei ca. 80 mm Durchmesser) pro Meter. VDE-Vorschriften begrenzen die zulässige Spannung auf 7,5 kV. Als Vorschaltgerät wählt man einen Streufeldtransformator. Im Leerlauf liefert er eine hohe Zündspannung, die im Betrieb bei einer Belastung von 50-100 mA auf 30 % abfällt. Die Leistungsaufnahme liegt bei ca. 30 W/m.
Die Lichtausbeute beträgt ca. 30 lm/W, die Leuchtdichte ca. 3 · 103 cd/m2. Die Lebensdauer beträgt, je nach Füllgas, bis zu 20 Jahre. Sie ist unabhängig von Ein- und Ausschaltvorgängen; eine Eigenschaft, die für blinkende Leuchtreklame vorteilhaft ist.
Unter dem Namen "Kaltlichtkathodenlampen" werden Leuchtröhren als Hintergrundbeleuchtung von Flachbildschirmen, als Lichtquelle in Scannern oder als dekorative Beleuchtung (Modding) in PCs eingesetzt.
Die Lichtfarbe ist abhängig von der Art des eingefüllten Gases oder Gasgemisches bzw. der ebenfalls verwendeten, alterungsanfälligen Nicht-Edelgase.
Die ersten Leuchtröhren waren mit Neon gefüllt. Umgangssprachlich werden Leuchtstofflampen oder Kaltlichtkathodenlampen daher noch heute, unabhängig von der Farbe, als Neonröhren bezeichnet.
Tauchen


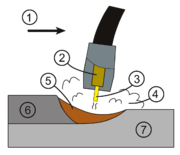
1.Vorschubrichtung 2.Kontakthülse 3.Schweißdraht 4.Schutzgas 5.Schmelzgut 6.Schweißraupe 7.Grundmaterial

Beim Tauchen wird ab einer bestimmten Wassertiefe unter anderem ein Gemisch aus Helium, Sauerstoff und Stickstoff eingesetzt (sog. - Trimix -). Der Vorteil liegt darin, dass das Narkosepotenzial von He unabhängig vom Umgebungsdruck immer gleich Null ist. Dies bedeutet, dass eine Stickstoff- bzw. Inertgasnarkose (Tiefenrausch) herausgezögert werden kann. Diese wird beim Tauchen mit Druckluft ein Problem, wenn der Umgebungsdruck einen bestimmten Wert, der von Person zu Person verschieden ist, überschreitet. Beim Tauchen mit Trimix sind neben dem geringeren Narkosepotenzial von He weitere Sachverhalte zu beachten, die das Dekompressionsverfahren betreffen: Die Diffusionsgeschwindigkeit von He in den Körpergeweben ist deutlich höher (Faktor 2,65) als die von N2. Dies liegt in der kleineren Atomgröße des He-Atoms begründet. Die Sättigung der Körpergewebe ist daher bei He um den gleichen Faktor größer als bei N2. Die Halbwertszeiten der Gewebe sind ebenfalls um den entsprechenden Faktor niedriger. Die resultierende Inertgasspannung ist dadurch ebenfalls entsprechend erhöht, wenn Druckexposition vorliegt.
Daraus folgert bei einer identischen Druckexposition, dass bei einem Tauchgang mit einem He-N2-O2-Gemisch verglichen mit einem N2-O2-Gemisch ein höherer Inertgaspartialruck in den Geweben vorhanden sein wird. Daher ist auch nicht, wie vielfach vermutet, die Gefahr einer Dekompressionskrankheit vermindert, wenn mit He getaucht wird, sondern diese ist, abhängig vom Heliumanteil im Atemgasgemisch, fallweise erhöht. Es ergeben sich daher andere Auftauchstrategien (i.e. verminderte Geschwindigkeiten, längere Dekompressionsaufenthalte, Dekompression mit reinem O2). Zudem bringt auch die geringere Dichte des He im Vergleich mit Stickstoff einen weiteren Vorteil mit sich. Die hohe Dichte des Stickstoffs bereitet dem Taucher in großen Tiefen das Problem, dass das erforderliche Atemminutenvolumen nicht mehr bewältigt werden kann. Die ca. 7-fach geringere Dichte des Heliums kann die sich aus dem o.g. Problem ergebenden Risiken stark reduzieren.
Schutzgas beim Schweißen
Argon dient in großen Mengen als Schutzgas bei bestimmten Schweißvorgängen. Immer wenn luftempfindliche, also oxidierbare Metalle geschmolzen oder verschweißt werden (z.B. Aluminium, Magnesium, Titan, Molybdän), so verhindert es den Luftzutritt, der Oxid- und Nitridbildung oder gar Selbstentzündung der Leichtmetalle zur Folge haben kann. Das Lichtbogenschweißen unter Edelgasatmosphäre erspart zudem den Einsatz von Flussmittel.
Weitere Verwendungen
Helium wird außerdem als unbrennbares Traggas zur Befüllung von Ballons verwendet.
In der Kerntechnik verwendet man es als Kühlmittel, da es nicht radioaktiv wird und einen geringen Neutronenabsorptionsquerschnitt hat.
Weiter dient es zur Aufrechterhaltung von extrem niedrigen Temperaturen, zum Beispiel bei der Kühlung der Sensoren von Infrarot-Teleskopen in Satelliten, als Kühlmittel, da es den tiefsten Siedepunkt aller Substanzen hat.
In Flüssigtreibstoffraketen wird oft der von Turbopumpen aus den Tanks gesaugte, verbrauchte Treibstoff durch Helium ersetzt, damit die Tanks durch den entstehenden Unterdruck nicht implodieren. Bei anderen Flüssigraketen befördert das in Hochdrucktanks gespeicherte Helium den Treibstoff durch diesen hohen Druck in die Triebwerke.
Xenon findet wegen seiner hohen Atommasse seiner leichten Lager- und Förderfähigkeit sowie seiner Ungiftigkeit als Antriebsmedium in Ionenantrieben in der Raumfahrt Verwendung, obwohl es schwieriger ionisierbar ist als das früher bevorzugte, aber giftige Quecksilber.
Des Weiteren wird die Reaktionsträgheit der Edelgase (aus Kostengründen meist Argon oder Krypton) in Glühlampen ausgenützt, um eine Reaktion anderer Gase mit dem oft über 2000 °C heißen Wolframdrahtzu vermeiden.
Edelgasatmosphären sind ideale Medien, um chemische Reaktionen zu verhindern und reaktive Materialien zu schützen.
Lagerung und Transport
In großen Mengen werden Edelgase wie andere Gase in Stahlflaschen gelagert (zumeist mit 200 bar in 50 l Flaschen). Da jedoch große Mengen eines selteneren Edelgases teuer sind (Ne, Kr, Xe) und häufig nur kleine Mengen benötigt werden, wird das Edelgas bei kleinen Mengen als Einlagerungsatom in Klathraten gehandelt.
Das Edelgas befindet sich dann in den Hohlräumen des Wirtsgitters und wird durch van-der-Waals-Wechselwirkung an seiner Position gehalten. z. B. β-Hydrochinon-Clathrat[C6H4(OH)2]3E (E=Ar, Kr, Xe)
Mögliche Besetzung der Hohlräume: Ar = 67 %, Kr = 67 bis 74 %, Xe= 88%
Nur die in vergleichsweise größeren Mengen benötigten Edelgase Helium und Argon werden auch in Tankwagen zu Großverbrauchern transportiert.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 19.08. 2025