
Soda
| Soda | |
|---|---|
| Chemische Formel | Na2[CO3] - 10H2O |
| Mineralklasse | Wasserhaltige Carbonate ohne fremde Anionen 5.CB.10 (8. Auflage: V/D.02-20) (nach Strunz) 15.1.2.1 (nach Dana) |
| Kristallsystem | monoklin |
| Kristallklasse | monoklin-domatisch 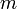
|
| Farbe | farblos, weiß, grau, gelb |
| Strichfarbe | weiß |
| Mohshärte | 1 bis 1,5 |
| Dichte (g/cm3) | gemessen: 1,478 ; berechnet: 1,458 |
| Glanz | Glasglanz |
| Transparenz | durchsichtig bis durchscheinend |
| Bruch | muschelig, spröde |
| Spaltbarkeit | deutlich nach {001}, unvollkommen nach {010} |
| Habitus | Ausblühungen und Krusten |
| Häufige Kristallflächen | |
| Zwillingsbildung | |
| Kristalloptik | |
| Brechungsindex | nα = 1,405 ; nβ = 1,425 ; nγ = 1,440 |
| Doppelbrechung (optische Orientierung) |
δ = 0,035 ; zweiachsig negativ |
| Winkel/Dispersion der optischen Achsen |
2vz ~ gemessen: 71° ; berechnet: 80° |
| Pleochroismus | farblos |
| Weitere Eigenschaften | |
| Chemisches Verhalten | wasserlöslich |
| Ähnliche Minerale | Thermonatrit, Trona |
| Besondere Kennzeichen | phosphoreszierend |
Soda (engl. Natron) ist ein Salz-Mineral aus der Mineralklasse der "Carbonate (und Verwandte)". Es kristallisiert im monoklinen Kristallsystem mit der chemischen Zusammensetzung Na2[CO3] - 10H2O und stellt damit das Dekahydrat des Natriumcarbonats dar.
Soda entwickelt meist farblose, weiße, graue oder gelbe Ausblühungen beziehungsweise krustige Überzüge auf Salzgesteinen.
Klassifikation
Die seit 2001 gültige und von der International Mineralogical Association (IMA) verwendete 9. Auflage der Strunz'schen Mineralsystematik ordnet Soda in die neue Klasse der "Carbonate und Nitrate" ein (die Borate bilden jetzt eine eigene Klasse). Dort gehört es nach wie vor in die Abteilung der "Carbonate ohne weitere Anionen, mit H2O" (Wasserfreie Carbonate mit fremden Anionen). Diese Abteilung ist allerdings noch präziser unterteilt nach der Größe der beteiligten Kationen, so dass das Mineral entsprechend seiner Zusammensetzung in der Unterabteilung "Mit großen Kationen (Alkali- und Alkali-Erden-Carbonaten)" zu finden ist, wo es als einziges Mitglied die unbenannte Gruppe 5.CB.10 bildet.
Die vorwiegend im englischen Sprachraum gebräuchliche Systematik der Minerale nach Dana ordnet Soda wie die alte Strunz'sche Systematik in die gemeinsame Klasse der "Carbonate, Nitrate und Borate" ein, dort allerdings in die Abteilung der "Wasserhaltigen Carbonate". Hier ist es einziges Mitglied in der unbenannten Gruppe 15.01.02 innerhalb der Unterabteilung der "Wasserhaltigen Carbonate mit A+(XO3) • x(H2O)".
Modifikationen und Varietäten
Soda ist eine von sieben Modifikationen der chemischen Verbindung Natriumcarbonat. Die anderen Modifikationen sind das
- wasserfreie Natriumcarbonat (Na2CO3, Mineral Natrit)
- Monohydrat (Na2CO3•H2O, Mineral Thermonatrit)
- Dihydrat (Na2Ca(CO3)2•2H2O, Mineral Pirssonit)
- Pentahydrat (Na2Ca(CO3)2•5H2O, Mineral Gaylussit)
- Heptahydrat (Na2CO3•7 H2O)
- Hydrogencarbonat (Na(HCO3)-Na2CO3•2H2O, Mineral Trona).
Bildung und Fundorte
Soda bildet sich vorwiegend durch Verdunstung an den Rändern von Salzseen oder durch Ausfällung am Seegrund bei kaltem Wetter.
Fundorte sind verschiedene Natronseen unter anderem in Ägypten, Äthiopien (Shala (See)), Bolivien (San Juan), Großbritannien, Mongolei (Ost-Gobi), Ungarn, Russland, Schweiz und den USA.
Struktur
Soda kristallisiert monoklin in der Raumgruppe Cc mit den Gitterparametern a = 12,83 Å; b = 9,03 Å; c = 13,44 Å und β = 123,0° sowie 4 Formeleinheiten pro Elementarzelle.
Verwendung
Bereits im Altertum wurde es allgemein als Reinigungsmittel unter anderem für Glas verwendet. Im alten Ägypten diente es zur Trocknung von Leichen und damit der Mumifizierung. Schon die Römer im Altertum versuchten mit alkalischer Birkenasche oder Soda Haare zu bleichen.
Soda ist ein wichtiger Rohstoff beziehungsweise wichtiges Hilfsmittel zur Herstellung von Glas, Bleichmitteln, Waschmitteln, Farbmitteln, Gerbereiprodukten.
Die natürlichen Vorkommen reichen dafür nicht aus, so dass es weltweit in großen Mengen hergestellt wird.

Basierend auf einem Artikel in Wikipedia.de

© biancahoegel.de;
Datum der letzten Änderung: Jena, den: 20.12. 2016