
Natriumhydrogencarbonat
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Toxikologische Daten | 4220 mg/kg (LD50, Ratte, oral) | ||||||
Natriumhydrogencarbonat (Trivialname: Natron) hat die Summenformel NaHCO3, ist ein Natriumsalz der Kohlensäure und zählt zu den Hydrogencarbonaten. Die Verbindung sollte nicht mit Natriumcarbonat (Soda, Summenformel Na2CO3) verwechselt werden. Gelegentlich werden für Natriumhydrogencarbonat auch die veralteten und chemisch unzutreffenden Trivialnamen doppeltkohlensaures Natron und Natriumbicarbonat (auch kurz NaBi) verwendet. Im Handel wird die auch als Backpulver genutzte Verbindung zudem unter den Bezeichnungen Speisesoda, Backsoda, Backnatron, Speisenatron sowie Markennamen angeboten.
Etymologie
Das Wort Natron existiert seit Beginn der Neuzeit im Deutschen (in den Formen anatron, natrum und natron) und entstand (wie spanisch, französisch und englisch natron sowie „Natrium“) über arabisch naṭrūn (bzw. anatrūn; vgl. das unterägyptische „Natrontal“ „Wadi an-Natrūn“, woher früher ein Gemisch aus Natriumcarbonat und Natriumhydrogencarbonat zum Wasserentzug aus Mumien bezogen wurde) aus griechisch nítron (νίτρον) (Herodot; attisch lítron (λίτρον)), welches auf altägyptisch ntr zurückzuführen ist. Aus dem griechischen nítron (Natron, Soda, Salpeter) war auch lateinisch (sal) nitrum und deutsch Salniter gebildet worden (woraus dann Nitrogen, Nitrat usw. herleitbar sind).
| Strukturformel | |
|---|---|
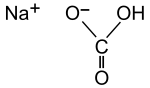 | |
| Allgemeines | |
| Name | Natriumhydrogencarbonat |
| Andere Namen | |
| Summenformel | NaHCO3 |
| Kurzbeschreibung | farbloser, geruchloser, kristalliner Feststoff |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 144-55-8 |
| EG-Nummer | 205-633-8 |
| ECHA-InfoCard | 100.005.122 |
| PubChem | 516892 |
| ChemSpider | 8609 |
| DrugBank | DB01390 |
| Eigenschaften | |
| Molare Masse | 84,01 g/mol−1 |
| Aggregatzustand | fest |
| Dichte | 2,22 g/cm3 (20 °C) |
| Schmelzpunkt | Zersetzung ab 270 °C |
| pKS-Wert |
|
| Löslichkeit | mäßig in Wasser (93,4 g/l bei 20 °C) |
| Thermodynamische Eigenschaften | |
| ΔHf0 | −950,8 kJ/mol |
Bereits im Wörterbuch der ägyptischen Sprache von Adolf Erman und Hermann Grapow wurden vor einem knappen Jahrhundert griechisch nítron (νίτρον) und hebräisch neter/nether mit dem altägyptischen Wort nṯr.j verknüpft, das im 2. Jahrtausend vor Christus etwa /natsₑra-/ ausgesprochen wurde. Da sich das Natronwort in dieser Zeit in vielen unverwandten, aber benachbarten Sprachen findet, muss diese Etymologie als wahrscheinlich betrachtet werden.
Altägyptisch nṯr.j bedeutet in Bezug auf Natron jedoch nicht „göttlich“ und bezeichnet auch das Natron nicht als göttliche Substanz, wie häufig zu lesen ist. Alle Gegenstände und Substanzen zur Vorbereitung eines Leichnams für das Begräbnis und der Mumifizierung heißen grundsätzlich nṯr.j, zum Beispiel auch Mumienbinden und Mumifizierungsgeräte, also „zum Begräbnis gehörende Sache“.
Vorkommen

Natriumhydrogencarbonat kommt als natürliches Mineral Nahcolith unter anderem in den Vereinigten Staaten vor. Es tritt meist feinverteilt in Ölschiefer auf und kann dann nur als Beiprodukt der Ölförderung gewonnen werden. Ein Bergbau besonders reicher Nahcolith-Horizonte wird im Bundesstaat Colorado betrieben, die jährliche Förderung lag im Jahre 2007 bei 93.440 Tonnen. Es gibt auch Fundorte in Europa.
Darstellung
Umsetzung von gesättigter Natriumcarbonatlösung mit Kohlenstoffdioxid unter Kühlung:
Dies ist eine Gleichgewichtsreaktion, die aber durch die relative Schwerlöslichkeit von Natriumhydrogencarbonat stark nach rechts verschoben ist. Das abfiltrierte Natriumhydrogencarbonat muss vorsichtig getrocknet werden, damit es sich nicht wieder zersetzt (in Umkehrung der Bildungsreaktion).
Auf diese Weise wurde es erstmals durch den Apotheker Valentin Rose den Jüngeren 1801 in Berlin dargestellt.
Im Solvay-Verfahren als Zwischenprodukt ausfallendes Natriumhydrogencarbonat wird wegen der mitgefällten Verunreinigungen (hauptsächlich Ammoniumchlorid) normalerweise nicht verwendet.
Eigenschaften
Natriumhydrogencarbonat ist ein farbloser, kristalliner Feststoff, der sich oberhalb einer Temperatur von 50 °C unter Abspaltung von Wasser und Kohlenstoffdioxid zu Natriumcarbonat zersetzt.
In Wasser löst es sich im Unterschied zu Natriumcarbonat mit nur schwach alkalischer Reaktion.
Natriumhydrogencarbonat besitzt eine monokline Kristallstruktur mit der Raumgruppe P21/c (Raumgruppen-Nr. 14) und den Gitterparametern a = 3,51 Å, b = 9,71 Å, c = 8,05 Å und β = 111° 51′. Die Verbindung bildet Mischkristalle mit Natriumcarbonat.
Verwendung
Natriumhydrogencarbonat wird hauptsächlich zur Herstellung von Backpulver und Brausepulver verwendet. Die weltweite Produktionsmenge liegt im 100.000-Tonnen-Bereich.
Die Verbindung findet allgemein vielfältige Anwendung:
- In der Lebensmitteltechnik
- als Bestandteil von Backpulvern bzw. Triebmitteln
- als Bestandteil von Brausepulvern
- In der Sportlerernährung
- Bei geeigneter Anwendung und Dosierung bei gesunden, trainierten und nicht mangelernährten Menschen kann ein positiver Effekt auf die Ausdauer für belegt oder wahrscheinlich angesehen werden.
- In der Medizin
- zum Zähneputzen (Natron bzw. baking soda ist wegen seiner abrasiven und somit aufhellenden Wirkung in einigen Zahnpasten enthalten, insb. in den USA)
- bei der professionellen Zahnreinigung (PZR) in der Prophylaxe
- als Mittel gegen Sodbrennen wegen der Neutralisationswirkung unter Bildung von ungiftigen Reaktionsprodukten (CO2 und Wasser); gilt heute als veraltet (siehe Protonenpumpenhemmer). NaHCO3 ist dennoch in vielen Produkten gegen Sodbrennen und säurebedingte Magenprobleme enthalten. Beispielsweise besteht Bullrich-Salz (Delta-Pronatura-Gruppe) zu 100 % aus Natriumhydrogencarbonat.
- als Antidot bei Vergiftungen durch Barbiturate, Salicylate und Trizyklische Antidepressiva
- als Bestandteil einer Trinklösung (zusammen mit Kaliumchlorid, Natriumchlorid und Macrogol) zur Darmreinigung als Vorbereitung einer Koloskopie (Darmspiegelung).
- als Puffersubstanz zum Ausgleich des Basendefizites bei der Hämodialyse (Azidosekorrektur). Bei der sogenannten Bicarbonatdialyse ist Natriumhydrogencarbonat der wohl wichtigste Bestandteil des Dialysats. Im Gegensatz zu Acetat oder Lactat muss NaHCO3 nicht erst verstoffwechselt werden, um seine Wirkung zu entfalten. Weltweit ist es wegen seiner Vorteile für das Herz-Kreislaufsystem die am häufigsten eingesetzte Puffersubstanz bei der Hämodialyse. Außerdem kommt es bei diesem Verfahren seltener zu Blutdruckabfällen, Übelkeit und Krämpfen.
- zur Behandlung der metabolischen Azidose und Hyperkaliämie
- In der Luftfahrttechnik
- zur Hitzeabsorption und zur Schaffung einer brandhemmenden Atmosphäre in Flugschreibern
- In der Umwelttechnik
- als Sorptionsmittel für saure Abgasbestandteile (SOx, HCl) in Rauchgasreinigungsanlagen (Bicar-Verfahren)
- Historisch zur Dehydratisierung von Leichen (Mumifizierung)
- In der Landwirtschaft
- als Mittel gegen Pilzerkrankungen wie Mehltau und Graufäule, bekannt unter dem Namen Steinhauers Mehltauschreck
- als pH-Wert-Puffer in der Milchviehfütterung
- als Käsereifungsmittel (pH-Abstumpfung, bei der Sauermilchkäserei) und zur Verzögerung der Milchgerinnung
- Als Bestandteil von Feuerlöschpulvern (Abgabe von CO2 bei Erhitzung)
- Zum Strecken von synthetischen Drogen wie Amphetamin sowie zur Herstellung von Crack aus Kokain
- Im Haushalt
- als Bestandteil von Feinwaschmitteln
- als Putzmittel, beispielsweise werden Fliesenfugen oder Sportschuhe aufgehellt, indem es mit Wasser gemischt und eingebürstet wird.
- Zum Entfernen angebrannter und verkrusteter Speisereste. Der Effekt beruht teilweise auf der Verseifung fetthaltiger Nahrungsmittelreste. Wirksamer (und aggressiver bei Kontakt mit Haut und Schleimhäuten) ist jedoch das stärker alkalisch reagierende (Wasch-)Soda (Natriumkarbonat).
- Eine Prise Natron im Kochwasser lässt Erbsen, Linsen und Bohnen schneller weich werden und nimmt verschiedenen Kohlsorten die blähende Wirkung.
- Als Beigabe zum fertigen Käsefondue macht es dieses leichter bekömmlich und luftig.
- Es neutralisiert Gerüche: Mundgeruch, Abflussrohre, muffige Schuhe, Kühlschrank, Katzentoilette, Kleintierkäfige.
- Als Mittel gegen Ameisen und Kakerlaken: Streut man Natron in die Löcher des Ameisenbaus und auf die Ameisenwege, nehmen die Ameisen das Natron auf und tragen es mit in ihren Bau. Natron ändert den pH-Wert im Körper der Ameisen, was zum Tode führt.
- Überschüssige Säure in Lebensmitteln wird durch Natron neutralisiert oder abgeschwächt. Dies ist etwa bei der Zubereitung von Konfitüren aus sauren Früchten wie Sanddorn oder Rhabarber von Bedeutung, da diese so einen milderen Geschmack erhalten und weniger Zucker verwendet werden muss. Auch zu einer Speise übermäßig zugesetzter Essig oder Zitronensaft kann durch Natron neutralisiert werden.
- In der Aquaristik
und im Poolwasser
- zur Erhöhung der Pufferkapazität zur Verhinderung eines Säuresturzes
- zur Regulierung des KH-Wertes, z.B. in der Meerwasseraquaristik, oder zur Regulierung der Alkalität in Swimmingpools (sogenannte Alka-Plus-Produkte bestehen aus Natriumhydrogencarbonat)
- In Spielzeugraketen dient es zusammen mit Essig oder Zitronensäure als Treibstoff (durch Bildung des Gases Kohlenstoffdioxid)
- Im Labor zur Neutralisation verschütteter Säuren, zumeist als 5%ige Lösung.
- Als nicht abrasives Strahlmittel in der Strahltechnik, Sodastrahlen
- Zum Lösen von Uran in Gesteinsformationen beim In-situ-leaching-Verfahren (ISL-V.)
Biologische Bedeutung
Mit Säuren reagiert es schäumend unter Bildung von Kohlenstoffdioxid und Wasser.
- Natriumhydrogencarbonat und Salzsäure reagieren zu Natriumchlorid, Kohlenstoffdioxid und Wasser.
Die Möglichkeit, Säuren durch HCO3− zu neutralisieren, ist für den Körper überlebenswichtig.
- Im Magen muss aufgrund der dort aktiven Enzyme ein saures Milieu herrschen, dies geschieht durch Produktion von Chlorwasserstoff (HCl), woraus sich zusammen mit Wasser der Magensaft (ca. 0,5-prozentige Salzsäure) bildet, dessen pH-Wert (nüchtern) bis auf 1–1,5 sinken kann. Die Epithelzellen der Magenwand, die bei einem so niedrigen pH-Wert sofort zugrunde gehen würden, schützen sich selbst durch Abgabe von mit HCO3− versetztem Schleim. Dringen H+-Ionen der Salzsäure in die Schleimschicht ein, so werden sie zu CO2 und Wasser neutralisiert. Das CO2 entweicht zumeist durch die Speiseröhre.
- Im Dünndarm wird wiederum eine alkalische Umgebung benötigt, da hier andere Enzyme die Spaltung der Nährstoffe übernehmen. Die Änderung des pH-Wertes erfolgt im Zwölffingerdarm (Duodenum) durch Einspeisung des Sekretes der Bauchspeicheldrüse, welches unter anderem ebenfalls – wie der im Magen abgegebene Schleim – HCO3− enthält.
- Hydrogencarbonat HCO3− ist der wichtigste Blutpuffer zur Regulierung des Säure-Basen-Haushalts des Menschen.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 18.11. 2025