Transmembranprotein
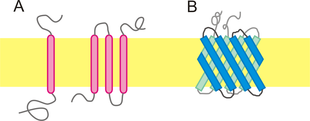
(A) α-helicale Domänen (rot) im singlepass (links) und im multipass
(B) β-Fass-Domänen (blau)
Transmembranproteine sind eine Gruppe der Membranproteine und durchqueren beide Blätter der Phospholipiddoppelschicht einer Biomembran, im Unterschied zu den einfach membranständigen Proteinen. Zu den Transmembranproteinen gehören funktionell sehr verschiedene Proteine wie zum Beispiel Transmembranrezeptoren (deren größte Untergruppe die heptahelikalen Rezeptoren sind), Porine, Ionenkanäle, Transporter, ATP-abhängige Pumpen und Zelladhäsionsmoleküle. Sie können in der Plasmamembran oder in der Membran eines Organells verankert sein und lassen sich nach ihren die Membran durchquerenden Proteinanteilen, der Transmembrandomäne, strukturell klassifizieren. Innerhalb der Biomembran sind Transmembranproteine teilweise lateral beweglich nach dem Fluid-Mosaik-Modell.
Transmembrandomäne
Die Aminosäuresequenz, die in einer Phospholipiddoppelschicht liegt, wird als Transmembrandomäne bezeichnet. Um die Phospholipiddoppelschicht zu durchdringen, muss eine Polypeptidkette hydrophobe Aminosäure-Seitenketten besitzen und ihre polare Rückgratgruppe gegen die relativ unpolaren Membranlipide abschirmen. Dies wird unter anderem durch die Bildung einer Sekundärstruktur erreicht, die zur Bildung von Wasserstoffbrückenbindungen beiträgt. Alle bekannten Transmembran-Segmente bestehen daher entweder aus α-Helices (sehr häufig, teilweise als Bündel) oder β-Fässern (selten). Mit etwa 27 % des gesamten Proteoms stellen Membranproteine mit α-Helices die größte Untergruppe der Membranproteine. Während bakterielle Transmembranproteine mit β-Fass meist geradzahlige β-Stränge aufweisen, besitzen eukaryotische Transmembranproteine mit β-Fass meistens 7 oder andere ungeradzahlige β-Stränge.
In sehr seltenen Fällen wie bei Gramicidin A kommt stattdessen eine β-Helix vor. Eine transmembrane Polyprolin-II-Helix wurde bislang nur künstlich erzeugt beschrieben.
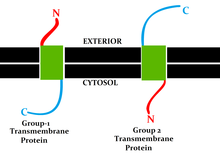
Bei Transmembranproteinen wird zwischen den Singlepass-Transmembranproteinen unterschieden, die die Membran nur einmal durchqueren, und den Multipass-Transmembranproteinen, die die Membran mehrmals durchqueren. Die Singlepass-Transmembranproteine werden weiter unterschieden in verschiedene Typen nach Art der Verankerung und der Lage ihrer Enden. Der N-Terminus liegt extrazellulär bei Typ-1-Transmembranproteinen, die in der Zellmembran verankert sind. Bei Typ-2-Transmembranproteinen liegt hier dagegen der C-Terminus extrazellulär. Die Einteilung erfolgt nach verschiedenen topologischen Determinanten, wie Orientierung der Transmembrandomäne in der Membran, angrenzende polare Seitenketten von Aminosäuren und Glykosylierungen. Die Proteintranslokation durch die Membran nach der Proteinbiosynthese am Ribosom läuft unter Beteiligung von Sec61, SRP und den SRP-Rezeptor. Die Sortierung zur jeweiligen Membran (Zellmembran, ER-Membran, lysosomale Membran oder mitochondriale Membran) erfolgt anhand von Signalsequenzen. Die Sortierung anhand von Signalsequenzen wird in Typ I-III für lösliche Proteine und Typ IV für Transmembranproteine unterteilt. Eine Phosphorylierung kann die Erkennung und somit die Sortierung beeinflussen. Eine Ubiquitinierung cytosolischer Bereiche führt zu einer Sortierung, die im Abbau am Proteasom endet. Teilweise werden Transmembranproteine nach der Translokation durch Chaperone gefaltet. Transmembranrezeptoren liegen oftmals gruppiert aneinander gebunden vor (engl. cluster).
Hydrophobizität der Transmembrandomäne
Transmembranproteine sind im Transmembranbereich (Transmembrandomäne von etwa acht bis zwölf Aminosäuren) gehäuft aus den weniger polaren bzw. hydrophoberen Aminosäuren aufgebaut, deren unpolare Seitenketten mit den Lipiden der Membran eine Protein-Lipid-Interaktion eingehen. In Transmembranproteinen sind daher verschiedene Aminosäuren mit vor allem unpolaren Seitenketten gehäuft zu finden, wie Phenylalanin, Glycin, Tryptophan, Methionin, Isoleucin, Threonin, Valin, Serin, Prolin, Cystein und Leucin, während die anderen Aminosäuren im Vergleich zu löslichen Proteinen vermindert auftreten.
Analytik
Die im Zuge einer Proteincharakterisierung zur Ermittlung der Proteinfaltung verwendeten Methoden umfassen Röntgen-Kristallstrukturanalyse, Elektronenmikroskopie und NMR-Spektroskopie. Die vollständige Proteinstruktur ist nur bei wenigen Membranproteinen bekannt. Transmembranproteine sind schwerer zu untersuchen als lösliche Proteine, da sie aufgrund der hydrophoben Aminosäuren mit Detergentien isoliert werden müssen und strukturell flexibler sind. Darüber hinaus sind sie oftmals strukturell instabiler und besitzen eine geringere biologische Halbwertszeit.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 14.06. 2025