
Prolin
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| Toxikologische Daten | > 5110 mg/kg (LD50, Ratte, oral) | ||||||||
L-Prolin, abgekürzt Pro oder P, [systematischer Name: (S)-Pyrrolidin-2-carbonsäure] ist eine nichtessentielle proteinogene heterocyclische sekundäre α-Aminosäure und wird wegen seiner Biosynthese aus Pyrrolin-2-carbonsäure [genauer: (S)-3,4-Dihydro-2H-pyrrol-2-carbonsäure] manchmal fälschlich als Iminosäure (eine heute obsolete Klassifizierung) bezeichnet.
| Strukturformel | ||
|---|---|---|
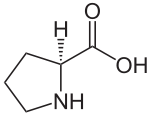
| ||
| Strukturformel von natürlich vorkommendem L-Prolin | ||
| Allgemeines | ||
| Name | Prolin | |
| Andere Namen |
| |
| Summenformel | C5H9NO2 | |
| Kurzbeschreibung | farbloser Feststoff mit aminartigem Geruch | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 210-189-3 | |
| ECHA-InfoCard | ||
| PubChem | ||
| Arzneistoffangaben | ||
| ATC-Code | ||
| Eigenschaften | ||
| Molare Masse | 115,13 g/mol−1 | |
| Aggregatzustand | fest | |
| Dichte | 1,35–1,38 g/cm3 (25 °C) | |
| Schmelzpunkt | Zersetzung: 220–222 °C (D- und L-Form) 210 °C (Racemat) | |
| pKS-Wert |
| |
| Löslichkeit |
| |
Stereoisomerie
In den Proteinen kommt, neben anderen Aminosäuren, ausschließlich L-Prolin [Synonym: (S)-Prolin] peptidisch gebunden vor. Enantiomer dazu ist das spiegelbildliche D-Prolin [Synonym: (R)-Prolin]. Racemisches DL-Prolin [Synonyme: (RS)-Prolin bzw. (±)-Prolin] hat nur geringe Bedeutung.
Wenn in diesem Text oder in der wissenschaftlichen Literatur „Prolin“ ohne weiteren Namenszusatz (Präfix) erwähnt wird, ist L-Prolin gemeint.
| Name | L-Prolin | D-Prolin |
| Andere Namen | (S)-Prolin | (R)-Prolin |
| Strukturformel | 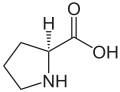 |
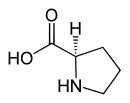
|
| CAS-Nummer | ||
| EG-Nummer | 205-702-2 | 206-452-7 |
| 210-189-3 (DL) | ||
| ECHA-Infocard | ||
|
| ||
| PubChem | ||
| DrugBank | – | |
| – (DL) | ||
Geschichte
Der Name Prolin stammt von Emil Fischer und leitet sich vom Pyrrolidin ab.
Vorkommen
Innerhalb von Proteinen kommt es sowohl in cis- als auch in trans-gebundener Konfiguration vor. L-Prolin hat erheblichen Einfluss auf die Faltung von Proteinen, da es wie Glycin aufgrund der häufig vorkommenden cis-Peptidbindung α-Helices und β-Faltblätter unterbrechen kann. Es kann auch eigene Motive bilden, die häufig als Signalsequenz für andere Proteine wirken.
Biosynthese
L-Prolin wird biochemisch aus L-Glutamat hergestellt. Hierfür werden insgesamt ein Molekül ATP sowie zwei Moleküle Reduktionsäquivalente in Form von NADPH benötigt.
L-Prolin ist die Vorstufe des L-Hydroxyprolins, das unter Beteiligung des Vitamins C nach Einbau in Kollagen entsteht und dessen mechanischen Eigenschaften bestimmt (Mangelerkrankung: Skorbut). Katalysiert durch eine Hydroxylase werden Prolylreste, je nach ihrer Position im Protein, entweder am β- oder am γ-Atom des Tetrahydropyrrolringes modifiziert.
Eigenschaften
Prolin liegt überwiegend als „inneres Salz“ bzw. Zwitterion vor, dessen Bildung dadurch zu erklären ist, dass das Proton der Carboxygruppe an das einsame Elektronenpaar des Stickstoffatoms der Aminogruppe wandert. Die Zersetzungstemperatur liegt bei > 185 °C.
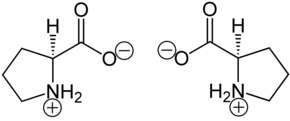
Im elektrischen Feld wandert das Zwitterion nicht, da es als Ganzes ungeladen ist. Genaugenommen ist dies am isoelektrischen Punkt (einem bestimmten pH-Wert) der Fall, bei dem das Prolin auch seine geringste Löslichkeit in Wasser hat.
Dadurch, dass das Stickstoffatom des Prolins in der Peptidgruppe nicht mit einem H-Atom verbunden ist, kann keine Wasserstoffbrückenbindung ausgebildet werden. An solchen Stellen einer Polypeptidkette tritt eine Störung der Sekundärstruktur (Knick oder Krümmung) auf.
Weitere Eigenschaften:
- Seitenkette: hydrophob
- Isoelektrischer Punkt: pH = 6,30
- Van-der-Waals-Volumen: 90 Å3
- Lipidlöslichkeit: LogP = −1,6
Funktionen
L-Prolin wird im menschlichen Körper z.B. für die Bildung von Kollagen, dem Protein, aus dem Bindegewebe und Knochen bestehen, benötigt. Ferner wird es als „Helixbrecher“ bezeichnet und findet sich oft am Übergang einer Alpha-Helix zu einer anderen Sekundärstruktur (häufig Random Coil) wieder. Prolin ist nämlich die einzige Aminosäure, deren Peptidbindung kein Wasserstoffatom aufweist. Folglich kann es sich nicht an der Bindung von Wasserstoffbrückenbindungen beteiligen. L-Prolin wird in der Ökotoxikologie als Biomarker verwendet, z.B. für Trockenstress, Salzstress, da es von Pflanzen vermehrt produziert wird, wenn der Wasserhaushalt unter Stress gerät. L-Prolin als zyklische Aminosäure wirkt als Puffer gegen manche Ionen, die ansonsten die Enzymtätigkeiten im Cytoplasma einschränken könnten.
Chemische Verwendung
Enantiomerenreines Prolin ist als Element des chiralen Pools Ausgangssubstanz für die Synthese des Evans-Auxiliars, des CBS-Reagenz, des Enders-Reagenzes (RAMP/SAMP) und ist ein vielbenutzter Katalysator in der Organokatalyse. Die Literatur über die Verwendung von (S)- oder (R)-Prolin und deren Derivate in der stereoselektiven Synthese ist umfangreich. Ein L-Prolin-Derivat dient als chiraler Selektor in der enantioselektiven Dünnschichtchromatographie. Der therapeutisch und wirtschaftlich bedeutende Arzneistoff Captopril wird aus L-Prolin synthetisiert.
Literatur>
- Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie. 20. Auflage. S. Hirzel Verlag, Stuttgart 1984, ISBN 3-7776-0406-2.
- Hans-Dieter Jakubke, Hans Jeschkeit: Aminosäuren, Peptide, Proteine. Verlag Chemie, Weinheim 1982, ISBN 3-527-25892-2.
- Jesse Philip Greenstein, Milton Winitz: Chemistry of Amino Acids. John Wiley & Sons, 1962, ISBN 0-471-32637-2.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 20.12. 2025