
β-Helix

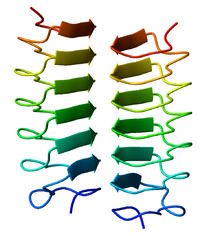
Die β-Helix ist eine Sekundärstruktur von Proteinen.
Eigenschaften
Eine β-Helix besteht als Proteinstruktur aus mehreren parallelen β-Strängen in helikaler Anordnung. Die β-Helix hat dabei zwei, drei oder vier Außenflächen. Proteine mit Pentapeptide Repeat besitzen vier Außenflächen. Aufgrund der wiederholten β-Stränge ist die Aminosäuresequenz oftmals repetitiv. Die β-Helix wird durch Wasserstoffbrücken zwischen den β-Strängen, teilweise auch durch ionische Bindungen und Protein-Protein-Interaktionen stabilisiert. Beispiele für Proteine mit rechtsgängigen β-Helices sind die Pektat-Lyase aus Aspergillus niger, das tailspike protein des Bakteriophagen P22, die Rhamnogalacturonase A aus Aspergillus aculeatus und ein Frostschutzprotein aus Tenebrio molitor. Beispiele für Proteine mit linksgängigen β-Helices sind ein Frostschutzprotein aus Choristoneura fumiferana, die UDP-N-Acetylglucosamin-Acyltransferase und eine archaeische Carboanhydrase. Bei manchen ist für eine korrekte Faltung ein Chaperon notwendig, von dem bisher zwei Typen beschrieben wurden. Die β-Stränge einer β-Helix sind relativ kurz und gerade, die β-Faltblätter haben daher nicht die übliche rechtshändige Krümmung. Im Ramachandran-Plot liegen die Peptidbindungen in einem engeren Bereich als übliche β-Faltblätter.
β-Helices in Amyloidosen

β-Helices entstehen durch Umfaltung aus anderen Proteinstrukturen bei einer Reihe von Protein-Faltungskrankheiten, den Amyloidosen. Hierzu gehören im Zentralnervensystem die Alzheimer'sche Krankheit (tau-Protein und amyloid precursor protein APP), die Parkinson'sche Krankheit (Synuclein), und Chorea Huntington (Huntingtin) sowie die Prion-Krankheiten. Außerhalb des ZNS findet sich Amyloid etwa bei den Ostertag-Amyloidosen (Lysozym, Apolipoprotein A1, Fibrinogen A oder Transthyretin). Bence Jones-Protein ist Immunglobulin leichte Kette, das bei monoklonalen Erkrankungen von Plasmazellen entsteht und dessen Präzipitation Nierenversagen verursacht. Amylin-Überproduktion und Fällung als Amyloid zerstört die β-Zellen des Pankreas und verursacht die sekundäre Insulin-Abhängigkeit bei Patienten mit Diabetes II. In Dialyse-Patienten kann es zur β-Mikroglobulin Amyloidose kommen, wenn das Protein nicht mit speziellen Membranen entfernt wird.
Literatur
- A. Mitraki, S. Miller, M. J. van Raaij: Review: conformation and folding of novel beta-structural elements in viral fiber proteins: the triple beta-spiral and triple beta-helix. In: Journal of structural biology. Band 137, Nummer 1–2, 2002 Jan–Feb, S. 236–247, doi:10.1006/jsbi.2002.4447, PMID 12064949.
- I. J. Clifton, M. A. McDonough, D. Ehrismann, N. J. Kershaw, N. Granatino, C. J. Schofield: Structural studies on 2-oxoglutarate oxygenases and related double-stranded beta-helix fold proteins. In: Journal of inorganic biochemistry. Band 100, Nummer 4, April 2006, S. 644–669, doi:10.1016/j.jinorgbio.2006.01.024, PMID 16513174.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 21.01. 2025