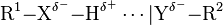Wasserstoffbrückenbindung
| Wasserstoffbrückenbindung |
 |
| Die Wasserstoffbrückenbindung zwischen zwei Wassermolekülen; die beteiligten Atome sind blau , die eigentliche Brückenbindung blau gepunktet dargestellt. |
Wasserstoffbrückenbindung, auch kurz Wasserstoffbrücke oder H-Brücke, ist eine anziehende Wechselwirkung eines kovalent gebundenen Wasserstoffatoms (R1−X−H) in der Regel mit einem freien Elektronenpaar eines Atoms Y einer Atomgruppierung |Y−R2. Diese Wechselwirkung tritt nur auf, wenn X elektronegativer als Wasserstoff ist, also H polar gebunden ist. Die Wechselwirkung des Wasserstoffatoms mit Y wird verstärkt, wenn |Y elektronegativ ist. Wasserstoffbrückenbindungen werden oft in der Form R1−X−H…|Y−R2 als gepunktete Linie dargestellt. Als elektronegative Atome haben Stickstoff (N), Sauerstoff (O) und Fluor (F) besondere Bedeutung.
Wasserstoffbrückenbindung ist eine Form der Nebenvalenzbindung und ihre Stärke liegt in der Regel deutlich unter denen einer kovalenten Bindung und der ionischen Bindungen. Wasserstoffbrückenbindungen zwischen Molekülen führen zu einem – im Verhältnis zur Molmasse – hohen Schmelz- und Siedepunkt der Verbindung. Wechselwirkungen innerhalb und zwischen Molekülen bestimmen die Struktur von Peptiden und Nucleinsäuren.
Entdeckung
Das Konzept der Wasserstoffbrücken wurde erstmals 1920 von Wendell Mitchell Latimer und Worth H. Rodebush zur Erklärung der hohen Dielektrizitätskonstante von Wasser beschrieben.
Struktur der Bindung


Wasserstoffbrücken liegen vor, wenn zwei funktionelle Gruppen über Wasserstoffatome in Wechselwirkung stehen. Dabei ist es unerheblich, ob die Bindung zwischen zwei Molekülen oder zwei entfernten Abschnitten eines – meist großen – Moleküls vorliegt. Man unterscheidet bei den funktionellen Gruppen zwischen dem Protonendonator (auch: Donor, Donator) und dem Protonenakzeptor. Der Donator ist ein elektronegatives Atom (z.B. Stickstoff, Sauerstoff oder Fluor), an das ein Wasserstoffatom kovalent gebunden ist. Der Akzeptor ist ein beliebiges anderes Atom mit freien Elektronenpaaren. Die Bindung des Wasserstoffatoms zum Akzeptor ist in der Regel schwächer (länger) und wird als punktierte Linie symbolisiert. Im Allgemeinen stellt man ein solches System wie folgt dar:
 .
.
Bestimmte funktionelle Gruppen können gleichzeitig als Donator und Akzeptor agieren. Ein einfaches Beispiel ist die Wasserstoffbrückenbindungen zwischen Wassermolekülen. Hier sind X und Y Sauerstoffatome:
 .
.
Durch den Unterschied in der Elektronegativitäten und durch die Wasserstoffbrückenbindung selbst, bilden sich Teilladungen (δ+, δ–) aus. Eine positive an dem Wasserstoffatom und negative Teilladungen an dem Donator X und dem Akzeptor Y.
Die Atome X−H…|Y sind häufig linear angeordnet (Bindungswinkel nahe 180°) und man kann die Bindung als 2-Elektronen-3-Zentren-Bindung betrachten. Die Bindung ist also nicht nur elektrostatisch (ionisch), selbst der schwache H…|Y-Bindungsteil hat eine Wirkungsrichtung, ähnlich wie kovalente Bindungen sie haben. Die Ausrichtung der freien Elektronenpaare des Akzeptors Y lenkt den Winkel zwischen H…|Y–R2, der daher meist nicht linear ist.
Eine Wasserstoffbrückenbindung kann man als einen gefrorenen Teilschritt eines Protonentransfers betrachten. Die Stärke der Bindung steigt mit der Säurekonstanten von R−X−H und der Basenkonstanten von |Y−R. Bei einer Wasserstoffbrückenbindung zwischen einem Oxoniumion (H3O+) und einem Wassermolekül bildet sich ein Dimer H(OH2)2+ mit starker Bindung, bei dem die beiden Bindungen des verbrückenden H-Atoms gleich lang sind:
 mit 138 kJ/mol.
mit 138 kJ/mol.
Liegen Wasserstoffbrückenbindungen zwischen schwer polarisierbaren Bindungspartnern mit schwachem Säure-Base-Verhalten vor, sind die H-Brücken sehr schwach und ungerichtet. In diesem Fall wird die Stärke der Wechselwirkung von Van-der-Waals-Kräften bestimmt.
Klassifizierung von Wasserstoffbrückenbindungen
George A. Jeffrey hat eine Klassifikation bezüglich der Stärke von Wasserstoffbrückenbindungen eingeführt.
- Starke Bindungen (63–167 kJ/mol): Beispielsweise die Wasserstoffbrückenbindung von Fluorwasserstoff
- Mittlere Bindungen (17–63 kJ/mol): Beispielsweise die Wasserstoffbrückenbindungen in Wasser oder in Kohlenhydraten
- Schwache Bindungen (< 17 kJ/mol): Beispielsweise C−H···O-Wasserstoffbrückenbindungen in Proteinen
Auswirkungen von Wasserstoffbrückenbindungen
Wasserstoffbrückenbindungen als zwischenmolekulare Kräfte wirken zwischen Molekülen einer Verbindung oder der Verbindung mit protischen Lösemitteln wie Wasser. Sie führen zu
- der Mischbarkeit von kurzkettigen Alkoholen mit Wasser und
- der guten Löslichkeit von Gasen, wie Ammoniak oder Kohlenstoffdioxid in Wasser,
- der Wasserlöslichkeit von einfachen Sacchariden (Monosaccharide, Disaccharide) und Polymeren wie Polyethylenglycol,
- erhöhten Siede- und Schmelzpunkten sowie erhöhten Verdampfungsenthalpien vieler Verbindungen die Hydroxy- oder Aminogruppen tragen.
-


Vergleich der Siedepunkte und molare Masse M von Alkanolen und Alkanen: Alkanole haben im Vergleich zu Alkanen ähnlicher Masse einen höheren Siedepunkt. Vergleich der Siedepunkte und molare Massen von Wasserstoffverbindungen der 4. Hautgruppe und der 6. Hauptgruppe der Elemente: Wasser hat einen auffällig hohen Siedepunkt. Bei Schwefelwasserstoff (H2S) sind die Wasserstoffbrückenbindungen schon sehr schwach und wirken kaum auf den Siedepunkt.
Wasserstoffbrücken in Biomolekülen
Wasserstoffbrücken sind verantwortlich für die speziellen Eigenschaften vieler für Lebewesen wichtiger Biomoleküle:
- Proteine: Stabilisierung von Sekundärstrukturelementen wie α-Helix und β-Faltblatt, sowie der Tertiärstruktur und Quartärstruktur (es treten bei Proteinen zusätzlich auch noch andere Bindungstypen auf).
- RNA: komplementäre Basenpaarung innerhalb von ncRNA-Molekülen oder zwischen RNA- und DNA-Molekülen.
- DNA: komplementäre Basenpaarung innerhalb der Doppelhelix; die beiden DNA-Stränge werden von den Wasserstoffbrückenbindungen zusammengehalten. Sie lassen sich jedoch (beim Kopiervorgang durch Helikasen) lösen („Reißverschluss“-Prinzip).
- Wirkstoffe: Die Bindungsaffinität von Wirkstoffen an ihre Zielstrukturen hängt maßgeblich von den gebildeten Wasserstoffbrücken ab.
-



Darstellung eines β-Faltblattes. R steht für den Rest der jeweiligen Aminosäure, Wasserstoffbrückenbindungen sind gestrichelt gezeigt. Das Basenpaar GC {Guanin (G) und Cytosin (C)} enthält drei gestrichelt blau gezeichnete Wasserstoffbrückenbindungen. Das Basenpaar AT {Adenin (A) und Thymin (T)} enthält zwei gestrichelt blau gezeichnete Wasserstoffbrückenbindungen.
Wasserstoffbrücken von Wasser


Durch die höhere Elektronegativität des Sauerstoffs mit 3,4 gegenüber der des Wasserstoffes mit 2,2 weist das Wassermolekül Partialladungen auf. Der Sauerstoff ist dadurch partiell negativ (δ−), die Wasserstoffatome partiell positiv (δ+). Die Wasserstoffbrücken bilden sich zwischen den unterschiedlichen Partialladungen aus.
Wasserstoffbrücken sind für eine Anzahl wichtiger Eigenschaften des Wassers verantwortlich. Darunter sind der flüssige Aggregatzustand bei Normalbedingungen, die Kohäsion, der relativ hohe Siedepunkt und die Dichteanomalie des Wassers
Die typische Bindungslänge von Wasserstoffbrückenbindungen in Wasser ist 0,18 nm. Es treten dabei zwei Typen von Bindungen auf. Sogenannte lineare Bindungen mit einem Bindungswinkel von 180° und nichtlineare 180° ± 20°, wobei die lineare Bindung überwiegt. Wohingegen ein rein tetraedrisches Netzwerk (Bindungswinkel 180°) zu jeweils 4 nächsten Nachbarn führen müsste (Koordinationszahl 4) ist die (durch Röntgenstreuung) gemessene Koordinationszahl unter Normalbedingungen 4,5. Bei abnehmender Dichte erniedrigt sich dieses Ordnungsmaß (im Gegensatz zu einer Erhöhung der Koordinationszahl bei den meisten anderen Flüssigkeiten) auf 4 und damit auf den Wert für eine ideale tetraedrische Struktur.
Beim Verdampfen müssen die Wasserstoffbrückenbindungen getrennt werden; hierdurch erklärt sich der (im Vergleich zu anderen Substanzen) hohe Energieaufwand, um flüssiges Wasser von 100 °C in Dampf von 100 °C umzuwandeln (Verdampfungswärme).
Intramolekulare Wasserstoffbrückenbindungen

Liegen in einem Molekül mehrere Donatoren/Akzeptoren vor, kann es innerhalb
des Moleküls zu Wasserstoffbrückenbindungen kommen, wie etwa bei der Ricinolsäure. Dort ist
sowohl eine Hydroxygruppe,
als auch eine Carboxygruppe
vorhanden. Eigentlich müsste die Hydroxygruppe den Schmelz- bzw. Siedepunkt
erhöhen. Allerdings ist der Siedepunkt der Ricinolsäure sogar niedriger als der
der Ölsäure, die sich nur
durch die fehlende Hydroxygruppe unterscheidet, da die Hydroxygruppe mit der
Carboxygruppe eine Wasserstoffbrückenbindung eingeht. Die Carboxygruppe kann
also nicht mehr in gleichem Ausmaß intermolekulare
Wasserstoffbrückenbindungen eingehen, als wenn die intramolekulare
Hydroxygruppe nicht vorhanden wäre. Auch die räumliche Struktur verändert sich;
es entstehen aufgrund der Anziehungskräfte zwischen den polaren Gruppen
pseudocyclische Strukturen.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 17.06. 2023