
Adenin
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| Toxikologische Daten | 227 mg/kg (LD50, Ratte, oral) | ||||||||
Adenin ist eine der vier Nukleinbasen in DNA und in RNA, neben Cytosin, Guanin und Thymin bzw. Uracil (in RNA).
Es ist eine heterocyclische organische Verbindung mit einem Puringrundgerüst und einer Aminogruppe in 6-Stellung. Das Desoxyadenosin in der DNA und das Adenosin in der RNA sind Nukleoside, die Adenin enthalten. Mit Thymin bzw. Uracil bildet es in der Watson-Crick-Basenpaarung zwei Wasserstoffbrücken.
Darstellung
- Lord-Todd-Synthese angewandt auf Formamidin und Phenylazomalononitril.
- Adenin kann als Pentamer der Blausäure angesehen werden und in flüssigem Ammoniak mit Ausbeuten von über 20 % aus dieser dargestellt werden.
Geschichte und biologische Bedeutung
Am 12. Januar 1885 berichtete der spätere Nobelpreisträger Albrecht Kossel vor der Berliner Chemischen Gesellschaft über eine bedeutende Entdeckung. Er konnte aus einer größeren Menge Rinder-Bauchspeicheldrüse, die in der Berliner Chemiefabrik Kahlbaum von Adolph Bannow (1844–1919) aufbereitet worden war, eine stickstoffreiche Base mit der Summenformel C5H5N5 isolieren, für die er, abgeleitet von dem griechischen Wort „aden“ für Drüse, den Namen Adenin vorschlug. Kossel wies sie auch als Spaltprodukt des Hefenukleins nach. Er konnte Adenin später auch als Spaltprodukt der Nukleinsäure nachweisen.
Adenin kann Bestandteil der DNA, RNA oder verschiedener Nukleoside und Nukleotide sein.
| Strukturformel | |
|---|---|
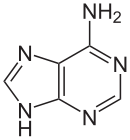 | |
| Allgemeines | |
| Name | Adenin |
| Andere Namen | |
| Summenformel | C5H5N5 |
| Kurzbeschreibung | hellgelber Feststoff |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 73-24-5 |
| EG-Nummer | 200-796-1 |
| ECHA-InfoCard | 100.000.724 |
| PubChem | 190 |
| ChemSpider | 185 |
| DrugBank | DB00173 |
| Arzneistoffangaben | |
| ATC-Code | A11HA |
| Eigenschaften | |
| Molare Masse | 135,13 g/mol |
| Aggregatzustand | fest |
| Siedepunkt | Zersetzung ab 360 °C |
| Sublimationspunkt | 220 °C |
| Löslichkeit | schlecht in Wasser (0,5 g/l bei 20 °C) |
Nukleoside
Über das N9-Atom des Fünfringes kann Adenin an das C1-Atom der Ribose N-glycosidisch gebunden werden; man spricht dann von einem Nukleosid, dem Adenosin. Bei der Bindung an Desoxyribose entsteht das Nukleosid Desoxyadenosin. Das synthetische Vidarabin enthält – im Gegensatz zu den meisten Nukleosiden – anstelle der Ribose die Arabinose.
-
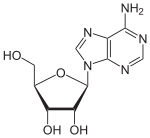
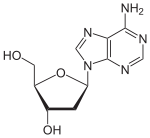
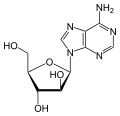
Adenosin, A Desoxyadenosin, dA Vidarabin, araA
Nukleotide
An Adenosin kann Phosphorsäure als Phosphatrest gebunden sein, so entstehen
- Adenosinmonophosphat (AMP)
- Cyclisches Adenosinmonophosphat (cAMP)
- Adenosindiphosphat (ADP)
- Adenosintriphosphat (ATP)
Entsprechende Moleküle entstehen, wenn die Phosphatreste an Desoxyadenosin gebunden werden (dAMP; dADP; dATP).
Adenosintriphosphat (ATP) spielt eine besondere Rolle im Energiestoffwechsel der Zelle. Durch die Reaktion ATP → ADP + P wird Energie frei, durch die Reaktion ADP + P → ATP wird Energie chemisch gespeichert.
Cyclisches Adenosinmonophosphat (cAMP) ist ein sehr verbreiteter Second Messenger der zellulären Signaltransduktion.
Adenin ist außerdem Bestandteil des Nicotinamidadenindinucleotids NAD+, das als Coenzym der Wasserstoffübertragung dient und so in der Zelle bei Redox-Reaktionen beteiligt ist. Adenin wird zur Biosynthese des Coenzyms S-Adenosyl-Methionin verwendet, welches bei biologischen Methylierungen Einsatz findet, z. B. durch eine Dam-Methylase.
Bestandteil der DNA und RNA
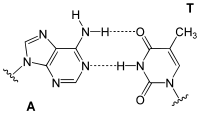
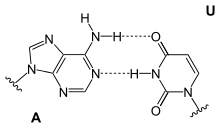
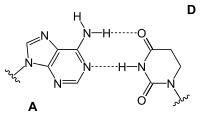
Adenin bildet in der DNA-Doppelhelix zwei Wasserstoffbrücken mit Thymidin aus. Bei der Transkription dagegen paart sich das Adenin des codogenen Strangs der DNA mit dem Uridin der gerade gebildeten mRNA. In der tRNA gibt es zudem Paarungen mit Dihydrouridin oder Pseudouridin.
 |
 |
 |
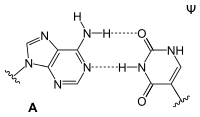 |
| A-T-Basenpaar (DNA) | A-U-Basenpaar (RNA) | A-D-Basenpaar (RNA) | A-Ψ-Basenpaar (RNA) |
Verwandte Verbindungen
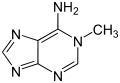 |
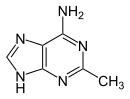 |
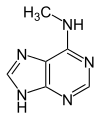 |
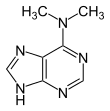 |
 |
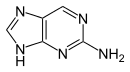 |
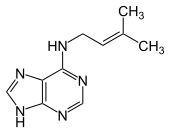
| 1-Methyladenin | 2-Methyladenin | N6-Methyladenin | N6,N6-Dimethyladenin | N6-Isopentenyladenin | 2-Aminopurin (Isoadenin) |


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 13.12. 2024
