
Cobalt
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Cobalt (chemische Fachsprache; lateinisch cobaltum, standardsprachlich Kobalt; vom Erstbeschreiber nach dem Kobalterz als Ausgangsmaterial Cobalt Rex benannt) ist ein chemisches Element mit dem Elementsymbol Co und der Ordnungszahl 27. Cobalt ist ein ferromagnetisches Übergangsmetall aus der 9. Gruppe oder Cobaltgruppe des Periodensystems. In der älteren Zählweise zählt es zur 8. Nebengruppe oder Eisen-Platin-Gruppe.
| Eigenschaften | |
|---|---|
| Allgemein | |
| Name, Symbol, Ordnungszahl | Cobalt, Co, 27 |
| Elementkategorie | Übergangsmetalle |
| Gruppe, Periode, Block | 9, 4, d |
| Aussehen | metallisch mit einem bläulich-gräulichen Farbton |
| CAS-Nummer | 7440-48-4 |
| Massenanteil an der Erdhülle | 37 ppm |
| Physikalisch | |
| Aggregatzustand | fest |
| Modifikationen | 2 |
| Kristallstruktur | hexagonal |
| Dichte | 8,90 g/cm³ (20 °C) |
| Mohshärte | 5,0 |
| Magnetismus | ferromagnetisch |
| Schmelzpunkt | 1768 K (1495 °C) |
| Siedepunkt | 3173 K (2900 °C) |
| Molares Volumen | 6,67 · 10−6 m3/mol |
| Verdampfungswärme | 390 kJ/mol |
| Schmelzwärme | 17,2 kJ/mol |
| Schallgeschwindigkeit | 4720 m/s |
| Spezifische Wärmekapazität | 421 J·kg−1·K−1 |
| Austrittsarbeit | 5,0 eV |
| Elektrische Leitfähigkeit | 16,7 · 106 A·V−1·m−1 |
| Wärmeleitfähigkeit | 100 W·m−1·K−1 |
| Chemisch | |
| Oxidationszustände | 2, 3 |
| Oxide (Basizität) | amphoter (neutral) |
| Normalpotential | −0,28 V (Co2+ + 2 e− → Co) |
| Elektronegativität | 1,88 (Pauling-Skala) |
Geschichte
Cobalterze und Cobaltverbindungen sind seit langer Zeit bekannt und wurden als Cobaltblau (Thénards Blau und Zaffer) vorwiegend zum Färben von Glas und Keramik verwendet. Im Mittelalter wurden sie häufig für wertvolle Silber- und Kupfererze gehalten. Da sie sich aber nicht verarbeiten ließen und wegen des Arsengehalts beim Erhitzen schlechte Gerüche abgaben, wurden sie als verhext angesehen. Angeblich hätten Kobolde das kostbare Silber aufgefressen und an seiner Stelle wertlosere silberfarbene Erze ausgeschieden. Neben Cobalt waren dies auch Wolfram- und Nickelerze. Diese Erze wurden von den Bergleuten dann mit Spottnamen wie Nickel, Wolfram (etwa „Wolfs-Schaum“, lat. lupi spuma) und eben Kobolderz, also Cobalt belegt. 1735 entdeckte der schwedische Chemiker Georg Brandt bei der Aufbereitung von Kobalterzen das bis dahin unbekannte Metall, beschrieb seine Eigenschaften und gab ihm seinen heutigen Namen. 1780 entdeckte Torbern Olof Bergman bei der genaueren Untersuchung der Eigenschaften, dass Cobalt ein Element ist.
Eigenschaften
Physikalische Eigenschaften
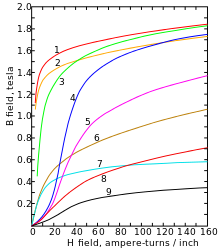
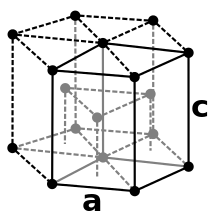
Cobalt ist ein stahlgraues, sehr zähes Schwermetall mit einer Dichte von 8,89 g/cm³. Es ist ferromagnetisch mit einer Curie-Temperatur von 1150 °C. Cobalt tritt in zwei Modifikationen auf: einer hexagonal-dichtesten (hcp) Kristallstruktur in der Raumgruppe P63/mmc (Raumgruppen-Nr. 194) mit den Gitterparametern a = 250,7 pm und c = 406,9 pm sowie zwei Formeleinheiten pro Elementarzelle und einer kubisch-flächenzentrierten Form (fcc) mit dem Gitterparameter a = 354,4 pm. Die hcp Modifikation (α-Cobalt, historisch ε-Cobalt[11]) ist bei tieferen Temperaturen stabil und wandelt bei ca. 450 °C in die fcc Modifikation (β-Cobalt, historisch α-Cobalt) um.
Als typisches Metall leitet es Wärme und Strom gut, die elektrische Leitfähigkeit liegt bei 26 Prozent von der des Kupfers.
Eine Besonderheit stellt die Atommasse des natürlich vorkommenden Cobalts dar; sie ist mit 58,93 größer als die mittlere Atommasse von Nickel mit 58,69, dem nächsten Element im Periodensystem. Diese Besonderheit gibt es auch zwischen Argon und Kalium sowie zwischen Tellur und Iod.
Chemische Eigenschaften
Im chemischen Verhalten ist es dem Eisen und Nickel ähnlich, an der Luft durch Passivierung beständig; es wird nur von oxidierend wirkenden Säuren gelöst. Cobalt zählt mit einem Normalpotential von −0,277 V zu den unedlen Elementen. In Verbindungen kommt es vorwiegend in den Oxidationsstufen +II und +III vor. Es sind jedoch auch die Oxidationsstufen −I, 0, +I, +II, +III, +IV und +V in Verbindungen vertreten. Cobalt bildet eine Vielzahl von meist farbigen Komplexen. Darin ist, im Gegensatz zu kovalenten Verbindungen, die Oxidationsstufe +III häufiger und stabiler als +II.
Isotope
Es sind insgesamt 30 Isotope und 18 weitere Kernisomere zwischen 47Co und 77Co bekannt. Natürliches Cobalt besteht dabei vollständig aus dem Isotop 59Co. Das Element ist daher eines der 22 Reinelemente. Dieses Isotop lässt sich durch die NMR-Spektroskopie untersuchen.
Das Nuklid 57Co zerfällt über Elektroneneinfang zu 57Fe. Die beim Übergang in den Grundzustand des Tochterkerns emittierte Gammastrahlung hat eine Energie von 122,06 keV (85,6 %) und 14,4 keV (9,16 %). Hauptanwendung von 57Co ist die Mößbauerspektroskopie zur Unterscheidung von zweiwertigem und dreiwertigem Eisen.
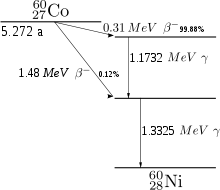
Das langlebigste der instabilen Isotope ist 60Co (Cobalt-60, Spin 5+), das mit einer Halbwertszeit von 5,27 Jahren unter Betazerfall zunächst in einen angeregten Zustand von 60Ni (Spin 4+) und anschließend unter Aussendung von Gammastrahlung (zwei Gammaquanten der Energie 1,17 und 1,33 MeV) in den Grundzustand (Spin 0+) dieses Nuklids zerfällt. Aus diesem Grund wird 60Co als Gammastrahlungsquelle zur Sterilisierung oder Konservierung von Lebensmitteln, zur Materialuntersuchung (Durchstrahlungsprüfung) und in der Krebstherapie („Kobaltkanone“) verwendet. In der Medizin können auch andere Isotope wie 57Co oder 58Co als Tracer verwendet werden. 60Co wird ausschließlich künstlich durch Neutronenaktivierung aus 59Co gewonnen. Als Neutronenquelle für die Herstellung kleinerer Mengen dienen Spontanspaltungsquellen wie 252Cf, zur Herstellung größerer Mengen werden 59Co-Pellets dem Neutronenfluss in Kernreaktoren ausgesetzt.
Die Entstehung von 60Co aus 59Co unter Neutronenstrahlung könnte potentiell auch zur Verstärkung der Wirkung von Kernwaffen benutzt werden, bei denen Neutronenstrahlung entsteht, indem diese mit Cobalt ummantelt würden (Cobaltbombe). Bei der Detonation würde dann der starke Gammastrahler gebildet, durch den die Umgebung stärker kontaminiert würde als durch die Kernexplosion allein. Wird 60Co nicht sachgerecht entsorgt, sondern mit anderem Cobalt eingeschmolzen und zu Stahl verarbeitet, können daraus gefertigte Stahlteile in schädlichem Maß radioaktiv sein.
Mit 60Co wurde das Wu-Experiment vorgenommen, durch das die Paritätsverletzung der schwachen Wechselwirkung entdeckt wurde.
Vorkommen

Cobalt ist ein seltenes Element mit einer Häufigkeit in der Erdkruste von 0,004 Prozent. Damit steht es in der Liste der nach Häufigkeit geordneten Elemente an dreißigster Stelle. Elementar kommt es nur äußerst selten in Meteoriten sowie im Erdkern vor. In vielen Mineralen ist Cobalt vertreten, kommt jedoch meist nur in geringen Mengen vor. Das Element ist stets mit Nickel, häufig auch mit Kupfer, Silber, Eisen oder Uran vergesellschaftet. Nickel ist dabei etwa drei- bis viermal so häufig wie Cobalt. Beide Metalle zählen zu den siderophilen Elementen und sind für basische und ultrabasische Magmatite charakteristisch.
Cobalt findet sich als Spurenelement in den meisten Böden. Es gibt eine Reihe Cobalterze, in denen sich das Cobalt durch Verwitterung oder andere Prozesse angereichert hat. Die wichtigsten sind: Cobaltit (veraltet Kobaltglanz; CoAsS), Linneit und Siegenit (veraltet und irreführend Kobaltnickelkies; (Co,Ni)3S4), Erythrin (veraltet Kobaltblüte), Asbolan (veraltet Erdkobalt), Skutterudit (Speiskobalt, Smaltin, CoAs3) und Heterogenit (CoOOH). Der Cobaltgehalt der sulfidischen Erze ist aber gering, meist nur 0,1–0,3 Prozent.
Die weltweit bekannten Cobalt-Reserven betragen 25 Millionen Tonnen. Die wichtigsten Erzlagerstätten befinden sich in der Demokratischen Republik Kongo und in Sambia, wo das Cobalt zusammen mit Kupfer auftritt, außerdem in Kanada, Marokko, Kuba, Russland, Australien und den USA. Weitere 120 Millionen Tonnen Cobalt werden in der Erdkruste auf den Böden des Atlantischen, Pazifischen und des Indischen Ozeans vermutet.
Gewinnung und Darstellung


Cobalt wird überwiegend aus Kupfer- und Nickelerzen gewonnen. Die genaue Gewinnungsart ist von der Zusammensetzung des Ausgangserzes abhängig. Zunächst wird ein Teil der vorhandenen Eisensulfide (FeS und FeS2) durch Rösten in Eisenoxid umgewandelt und mit Siliciumdioxid als Eisensilicat verschlackt. Es entsteht der sogenannte Rohstein, der neben Cobalt noch Nickel, Kupfer und weiteres Eisen als Sulfid oder Arsenid enthält. Durch weiteres Abrösten mit Natriumcarbonat und Natriumnitrat wird weiterer Schwefel entfernt. Dabei bilden sich aus einem Teil des Schwefels und Arsens Sulfate und Arsenate, die mit Wasser ausgelaugt werden. Es bleiben die entsprechenden Metalloxide zurück, die mit Schwefel- oder Salzsäure behandelt werden. Dabei löst sich nur Kupfer nicht, während Nickel, Cobalt und Eisen in Lösung gehen. Mit Chlorkalk kann anschließend selektiv Cobalt als Cobalthydroxid ausgefällt und damit abgetrennt werden. Durch Erhitzen wird dieses in Cobalt(II,III)-oxid (Co3O4) umgewandelt und anschließend mit Koks oder Aluminiumpulver zu Cobalt reduziert:
Der größte Teil von Cobalt wird durch Reduktion der Cobalt-Nebenprodukte des Nickel- und Kupferabbaus und der Schmelze gewonnen. Weil Cobalt in der Regel als Nebenprodukt anfällt, hängt die Cobaltversorgung in hohem Maße von der wirtschaftlichen Durchführbarkeit des Kupfer- und Nickelabbaus in einem bestimmten Markt ab.
Es gibt verschiedene Methoden, um Cobalt von Kupfer und Nickel zu trennen, abhängig von der Cobaltkonzentration und der genauen Zusammensetzung des verwendeten Erzes. Eine Methode ist die Schaumflotation, bei der Tenside an verschiedene Erzbestandteile binden, was zu einer Anreicherung von Cobalterzen führt. Durch anschließendes Rösten werden die Erze in Cobalt(II)-sulfat umgewandelt und Kupfer und Eisen oxidiert. Durch Auswaschen mit Wasser wird das Sulfat zusammen mit den Arsenaten extrahiert. Die Rückstände werden weiter mit Schwefelsäure ausgelaugt, was eine Kupfersulfatlösung ergibt. Cobalt kann auch aus der Kupferschmelze ausgelaugt werden.
Förderung
Staaten mit der größten Fördermenge
| Land | 2006 | 2013 | 2016 |
|---|---|---|---|
| DR Kongo | 22000 | 54000 | 66000 |
| China | 1400 | 7200 | 7700 |
| Kanada | 5600 | 6920 | 7300 |
| Russland | 5100 | 6300 | 6200 |
| Brasilien | 1000 | 3000 | 5800 |
| Australien | 6000 | 6400 | 5100 |
| Sambia | 8600 | 5200 | 4600 |
| Kuba | 4000 | 4200 | 4200 |
| Philippinen | 3000 | 3500 | |
| Neukaledonien | 1100 | 3190 | 3300 |
| Südafrika | 3000 | 3000 | |
| Marokko | 1500 | 1700 | |
| restliche Länder | 1200 | 8000 | 8300 |
| Gesamt | 57.500 | 110.000 | 123.000 |

Verwendung

Cobalt wurde in Form von Oxiden, Sulfaten, Hydroxiden oder Carbonaten als Erstes für hitzefeste Farben und Pigmente, z.B. für die Bemalung von Porzellan und Keramik verwendet . Danach folgte die wohl bekannteste dekorative Anwendung in Form des blauen Kobaltglases. Nach 1800 wurde das Cobaltaluminat (CoAl2O4) als farbkräftiges Pigment industriell hergestellt.
Cobalt dient heute als Legierungsbestandteil zur Erhöhung der Warmfestigkeit legierter und hochlegierter Stähle, insbesondere Schnellarbeitsstahl und Superlegierungen, als Binderphase in Hartmetallen und Diamantwerkzeugen. Seine Verwendung als Legierungselement und in Cobaltverbindungen macht es zu einem strategisch wichtigen Metall. (Siehe Vitallium: Turbinenschaufel, chemische Apparate.) Eingesetzt werden Cobaltstähle z.B. für hochbelastete Werkteile, die hohe Temperaturen aushalten müssen, wie z.B. Ventilsitzringe in Verbrennungsmotoren oder Leitschaufeln in Gasturbinen.
Superlegierungen auf Cobaltbasis haben in der Vergangenheit den größten Teil des erzeugten Cobalt verbraucht. Die Temperaturstabilität dieser Legierungen macht sie für Turbinenschaufeln von Gasturbinen und Flugzeugtriebwerken geeignet, obwohl Einkristalllegierungen auf Nickelbasis ihre Leistung übertreffen. Cobaltbasierte Legierungen sind auch korrosions- und verschleißfest, sodass sie wie Titan zur Herstellung von orthopädischen Implantaten verwendet werden können, die sich mit der Zeit nicht abnutzen. Die Entwicklung verschleißfester Cobaltlegierungen begann im ersten Jahrzehnt des 20. Jahrhunderts mit den Stellitlegierungen, die Chrom mit unterschiedlichen Anteilen an Wolfram und Kohlenstoff enthielten. Legierungen mit Chrom- und Wolframcarbiden sind sehr hart und verschleißfest. Spezielle Cobalt-Chrom-Molybdän-Legierungen wie Vitallium werden für Prothesenteile verwendet. Cobaltlegierungen werden auch für Zahnersatz als nützlicher Ersatz für Nickel verwendet, das möglicherweise allergen ist. Einige Schnellarbeitsstähle enthalten auch Cobalt, um die Wärme- und Verschleißfestigkeit zu erhöhen. Die speziellen Legierungen von Aluminium, Nickel, Cobalt und Eisen, bekannt als Alnico, sowie von Samarium und Cobalt (Samarium-Cobalt-Magnet) werden in Dauermagneten verwendet.
Cobalt ist Bestandteil von magnetischen Legierungen, als Trockner (Sikkativ) für Farben und Lacke, als Katalysator zur Entschwefelung und Hydrierung, als Hydroxid oder Lithium-Cobalt-Dioxid (LiCoO2) in Batterien, in korrosions- bzw. verschleißfesten Legierungen und als Spurenelement für Medizin und Landwirtschaft. Cobalt wird ebenfalls in der Produktion magnetischer Datenträger wie Tonban- und Videokassetten verwendet, wo es durch Dotierung die magnetischen Eigenschaften verbessert. Seit geraumer Zeit dient Cobalt als Legierungsbestandteil für Gitarrensaiten.


Seit Lithium-Ionen-Akkumulatoren in den 1990er Jahren auf den Markt kamen, wird Cobalt für Akkumulatoren vor allem für mobile Anwendungen eingesetzt, da der Lithium-Cobaltoxid-Akkumulator eine besonders hohe Energiedichte aufweist. Der erste kommerziell erhältliche Lithium-Ionen-Akku kam als Lithium-Cobaltdioxid-Akkumulator von Sony im Jahr 1991 auf den Markt. Aufgrund der zu erwartenden zunehmenden Bedeutung von Akkumulatoren für mobile Elektronik und Elektromobilität rät der Bundesverband der Deutschen Industrie (BDI): „Aufgrund der hohen Konzentration der Kobaltvorkommen auf die politisch instabileren Staaten Kongo und Sambia wird eine verstärkte Forschung in Mangan- und Eisenphosphat-Elektroden und auch in Nickel-Elektroden, die keine beziehungsweise nur geringe Mengen Kobalt enthalten, grundsätzlich empfohlen“. In einem Positionspapier des BDI zu innovativen Antriebstechniken wird prognostiziert: „Der globale Rohstoffbedarf an Kobalt könnte allein durch die steigende Nachfrage nach Lithium-Ionen-Akkumulatoren bis zum Jahr 2030 gegenüber 2006 um das 3,4-Fache steigen“.
Lithium-Cobalt(III)-oxid wird häufig in Lithiumionenbatteriekathoden verwendet. Das Material besteht aus Cobaltoxidschichten mit eingelagertem Lithium. Während der Entladung wird das Lithium als Lithiumionen freigesetzt. Nickel-Cadmium-Batterien und Nickel-Metallhydrid-Batterien enthalten auch Cobalt, um die Oxidation von Nickel in der Batterie zu verbessern.
Obwohl im Jahr 2018 das meiste Cobalt in Batterien in einem mobilen Gerät verwendet wurde, sind wiederaufladbare Batterien für Elektroautos eine neuere Anwendung für Cobalt. Diese Industrie hat ihre Nachfrage nach Cobalt verfünffacht, was es dringend erforderlich macht, neue Rohstoffe in stabileren Gebieten der Welt zu finden. Die Nachfrage wird voraussichtlich anhalten oder zunehmen, wenn die Verbreitung von Elektrofahrzeugen zunimmt. Gleichzeitig geht der Kobaltanteil in Batterien für E-Autos immer weiter zurück. Moderne Batterien enthalten mit Stand 2019 nur noch rund ein Drittel des Kobalts wie ältere Akkus; der Autobauer Tesla arbeitet bereits an weitgehend kobaltfreien Batterien. LiFePo-Batterien, wie sie etwa für Solarbatterien verwendet werden, benötigen hingegen überhaupt kein Kobalt.
Katalysatoren auf Cobaltbasis werden bei Reaktionen mit Kohlenstoffmonoxid eingesetzt. Cobalt ist auch ein Katalysator im Fischer-Tropsch-Verfahren zur Hydrierung von Kohlenstoffmonoxid zu flüssigen Brennstoffen. Bei der Hydroformylierung von Alkenen wird häufig Cobaltoctacarbonyl als Katalysator verwendet, obwohl es häufig durch effizientere Katalysatoren auf Iridium- und Rhodiumbasis ersetzt wird, z. B den Cativa-Prozess.
Bei der Hydrodesulfurierung von Erdöl wird ein Katalysator verwendet, der von Cobalt und Molybdän abgeleitet ist. Dieses Verfahren hilft, das Erdöl von Schwefelverunreinigungen zu reinigen, die die Raffination flüssiger Brennstoffe beeinträchtigen.
Physiologie

Cobalt ist Bestandteil von Vitamin B12, dem Cobalamin, das für den Menschen überlebensnotwendig ist. Beim gesunden Menschen kann dieses Vitamin möglicherweise von Darmbakterien direkt aus Cobaltionen gebildet werden. Allerdings muss Cobalamin von dem im Magen produzierten Intrinsic Factor gebunden werden, um im Ileum aufgenommen werden zu können. Da der Produktionsort des vom Menschen hergestellten Cobalamin jedoch im Dickdarm liegt, ist eine Resorption nach aktuellem Wissensstand nicht möglich. Das Vitamin muss also zwingend durch die Nahrung aufgenommen werden. Es wird dennoch eine tägliche Zufuhr von 0,1 μg Cobalt als Spurenelement für den täglichen Bedarf für Erwachsene angegeben. Der Mangel an Vitamin B12 kann zu einer gestörten Erythropoese und damit zu Blutarmut führen. Bei Wiederkäuern beruht ein solcher Mangel überwiegend auf unzureichender Cobaltzufuhr. In der Tierproduktion wird dem Futter in Spuren Cobalt hinzugefügt, falls die Tiere von cobaltarmen Weideflächen ernährt werden müssen. Hierüber soll Wachstums- und Laktationsstörungen, Blutarmut und Appetitlosigkeit entgegengewirkt werden.
Bakterien im Magen von Wiederkäuern wandeln Cobaltsalze in Vitamin B12 um, eine Verbindung, die nur von Bakterien oder Archaeen produziert werden kann. Eine minimale Anwesenheit von Cobalt in Böden verbessert daher die Gesundheit weidender Tiere erheblich.
Auf Cobalamin basierende Proteine verwenden Corrin, um das Cobalt zu halten. Coenzym B12 weist eine reaktive C-Co-Bindung auf, die an den Reaktionen beteiligt ist. Beim Menschen hat B12 zwei Arten von Alkylliganden: Methyl und Adenosyl. Methylcobalamin fördert den Transfer von Methylgruppen. Die Adenosylversion von B12 katalysiert Umlagerungen, bei denen ein Wasserstoffatom unter gleichzeitigem Austausch des zweiten Substituenten X, der ein Kohlenstoffatom mit Substituenten, ein Sauerstoffatom eines Alkohols oder ein Amin sein kann, direkt zwischen zwei benachbarten Atomen übertragen wird. Methylmalonyl-CoA-Mutase wandelt Methylmalonyl-CoA in Succinyl-CoA um, ein wichtiger Schritt bei der Energiegewinnung aus Proteinen und Fetten.
Obwohl weitaus seltener als andere Metalloproteine (z. B. Zink und Eisen), sind neben B12 auch andere Cobaltoproteine bekannt. Diese Proteine umfassen Methionin-Aminopeptidase 2, ein Enzym, das beim Menschen und anderen Säugetieren vorkommt und den Corrin-Ring von B12 nicht verwendet, sondern Cobalt direkt bindet. Ein weiteres nichtkorriniertes Cobaltenzym ist die Nitrilhydratase, ein Enzym in Bakterien, das Nitrile metabolisiert.
Während kleine Überdosen von Cobalt-Verbindungen für den Menschen nur gering giftig sind, führen größere Dosen ab 25 bis 30 mg pro Tag zu Haut-, Lungen-, Magenerkrankungen, Leber-, Herz-, Nierenschäden und Krebsgeschwüren.
Mitte der 1960er Jahre kam es in Kanada und den USA zu einer Reihe von Fällen einer cobalt-induzierten Kardiomyopathie (Cobalt-Kardiomyopathie). In Quebec wurden 49, in Omaha 64 Patienten registriert. Die Symptome umfassten unter anderem Magenschmerzen, Gewichtsverlust, Übelkeit, Atemnot und Husten. Die Letalitätsrate betrug 40 Prozent. Autopsien ergaben schwere Schädigungen an Herzmuskel und Leber. Alle Patienten waren starke Biertrinker mit einem Konsum von 1,5 bis 3 Liter pro Tag. Sie konsumierten bevorzugt Sorten von lokalen Brauereien, die etwa einen Monat zuvor angefangen hatten, dem Bier Cobalt(II)-sulfat als Schaumstabilisator beizumischen. Die Grenzwerte für Cobalt in Lebensmitteln wurden hierbei nicht überschritten. Das Auftreten der Krankheitsfälle kam unmittelbar zum Stillstand, nachdem die Brauereien die Cobalt(II)-sulfat-Beimischungen eingestellt hatten.
Cobalt(II)-Salze aktivieren die hypoxie-induzierbaren Transkriptionsfaktoren (HIF) und steigern die Expression HIF-abhängiger Gene. Hierzu gehört das Gen für Erythropoietin (EPO). Cobalt(II)-Salze könnten von Sportlern missbraucht werden, um die Bildung roter Blutzellen zu fördern.
Nachweis
Eine relativ aussagekräftige Vorprobe für Cobalt ist die Phosphorsalzperle, die von Cobaltionen intensiv blau gefärbt wird. Im Kationentrennungsgang kann es neben Nickel mit Thiocyanat und Amylalkohol nachgewiesen werden, es bildet beim Lösen im Amylalkohol blaues Co(SCN)2. Das in Wasser rotviolette Cobalt(II)-thiocyanat wird beim Versetzen mit Aceton ebenfalls blau.
Quantitativ kann Cobalt mit EDTA in einer komplexometrischen Titration gegen Murexid als Indikator bestimmt werden.
Verbindungen
Cobalt tritt in seinen Verbindungen meist zwei- oder dreiwertig auf. Diese Verbindungen besitzen oft kräftige Farben. Wichtige Cobaltverbindungen sind:
Oxide
Cobalt(II)-oxid ist ein olivgrünes, in Wasser unlösliches Salz. Es bildet eine Natriumchlorid-Struktur der Raumgruppe Fm3m (Raumgruppen-Nr. 225). Cobalt(II)-oxid wird als Rohstoff für die Herstellung von Pigmenten verwendet, insbesondere zur Herstellung des Pigments Smalte, das auch in der Keramikindustrie verwendet wird. Außerdem kann es zur Herstellung von Kobaltglas sowie von Thénards Blau verwendet werden. Cobalt(II,III)-oxid ist ein schwarzer Feststoff und zählt zur Gruppe der Spinelle.
Cobalt(II,III)-oxid ist ein wichtiges Zwischenprodukt bei der Gewinnung von metallischen Cobalt. Durch Rösten und Auslaugen wird aus verschiedenen Cobalterzen (meist Sulfiden oder Arseniden) zunächst Cobalt(II,III)-oxid gewonnen. Dieses kann nun mit Kohlenstoff oder aluminothermisch zum Element reduziert werden.
Cobalt(III)-oxid ist ein grau-schwarzer Feststoff, welcher praktisch unlöslich in Wasser ist. Bei einer Temperatur über 895 °C spaltet es Sauerstoff ab, wobei sich Cobaltoxide wie Co3O4 und CoO bilden.
Halogenide
_chloride.jpg)
_chloride_hexahydrate.jpg)
Cobalt(II)-chlorid ist ein im wasserfreien Zustand blaues, als Hexahydrat rosafarbenes Salz. Es hat eine trigonale Kristallstruktur vom Cadmium(II)-hydroxid-Typ mit der Raumgruppe P3m1 (Raumgruppen-Nr. 164). Wasserfreies Cobalt(II)-chlorid ist sehr hygroskopisch und nimmt leicht Wasser auf. Dabei ändert es sehr charakteristisch seine Farbe von blau nach rosa. Der entgegengesetzte Farbwechsel von rosa auf blau ist ebenfalls möglich, indem man das Hexahydrat auf Temperaturen oberhalb 35 °C erhitzt. Wegen des typischen Farbwechsels diente es als Feuchtigkeits-Indikator in Trockenmitteln wie etwa Kieselgel. Mit Hilfe von Cobalt(II)-chlorid lässt sich Wasser auch in anderen Lösungen nachweisen. Auch wird es als so genannte Geheimtinte benutzt, da es als Hexahydrat in wässriger Lösung auf dem Papier kaum sichtbar ist, wenn es aber erhitzt wird, tritt tiefblaue Schrift hervor.
Cobalt(II)-bromid ist ein grüner hygroskopischer Feststoff, der an der Luft in das rote Hexahydrat übergeht. In Wasser ist es mit roter Farbe leicht löslich. Cobalt(II)-iodid ist eine schwarze graphitähnliche hygroskopische Masse, die an Luft langsam schwarzgrün anläuft. Sie ist löslich in Wasser, wobei die verdünnte Lösungen rot aussehen, konzentrierte Lösungen bei niedriger Temperatur rot, bei höherer Temperatur alle Nuancen von braun bis olivgrün annehmen. Cobalt(II)-bromid und Cobalt(II)-iodid besitzen eine hexagonale Cadmiumiodid-Kristallstruktur der Raumgruppe P63mc (Raumgruppen-Nr. 186).
Weitere Verbindungen
Cobalt(II)-nitrat ist ein Salz der Salpetersäure, gebildet aus dem Cobaltkation und dem Nitratanion. Das braunrote und hygroskopische Salz liegt in der Regel als Hexahydrat vor und bildet monokline Kristalle, die in Wasser, Ethanol und anderen organischen Lösemitteln gut löslich sind.
Cobalt(II)-oxalat ist ein brennbarer, schwer entzündbarer, kristalliner, rosa Feststoff, der praktisch unlöslich in Wasser ist. Er zersetzt sich bei Erhitzung über 300 °C. Es kommt in zwei allotropen Kristallstrukturen vor. Eine besitzt eine monokline Kristallstruktur mit der Raumgruppe C2/c (Raumgruppen-Nr. 15), die andere eine orthorhombische Kristallstruktur mit der Raumgruppe Cccm (Raumgruppen-Nr. 66). Cobalt(II)-oxalat wird hauptsächlich zur Herstellung von Cobaltpulver verwendet. Das gelblich-rosa Tetrahydrat wird bei der Herstellung von Katalysatoren verwendet.
Cobalt(II)-sulfat ist im wasserfreien Zustand ein violettstichig-rotes, hygroskopisches Salz. Cobalt(II)-sulfat wird zur Herstellung von Pigmenten, Glasuren, in der Porzellanmalerei, zur Tonung von Papieren (Fotografie), in Bädern für Cobalt-Electroplating und zur Spurenelementsupplementierung in der Aquaristik u. a. verwendet.
Cobaltgelb ist ein feines, leichtes kristallines Pulver und wird als Pigment für Öl- und Aquarellmalerei verwendet.
Thénards Blau ist ein blaues Pigment, das durch Sintern von Cobalt(II)-oxid mit Aluminiumoxid bei 1200 °C hergestellt wird. Es ist äußerst stabil und wurde in der Vergangenheit als Farbstoff für Keramik (insbesondere chinesisches Porzellan), Schmuck und Farben verwendet. Transparente Gläser werden mit dem Kobaltpigment-Smalt auf Siliciumdioxidbasis getönt.
Das Pigment Rinmans Grün ist ein türkisgrünes Pulver und wird vor allem für Ölfarben und Zementfarben verwendet. Rinmans Grün ist ein beliebter Nachweis für Zink. Zinkoxid oder Zinkhydroxid wird auf einer Magnesiarinne mit einer geringen Menge einer stark verdünnten Cobaltnitratlösung versetzt. Beim schwachen Glühen in der oxidierenden Flamme entsteht Rinmans Grün.
Cobaltkomplexe
-chloride.jpg)
Aus einer Cobalt(II)-chloridlösung fällt bei Zugabe von Ammoniaklösung zunächst ein Niederschlag von Cobalt(II)-hydroxid aus, der sich im Überschuss von Ammoniaklösung und Ammoniumchlorid bei Gegenwart von Luftsauerstoff als Oxidationsmittel unter Bildung von unterschiedlichen Ammincobalt(III)-komplexen auflöst. Hierbei entstehen insbesondere das orangegelbe Hexaammincobalt(III)-chlorid und das rote Aquapentaammincobalt(III)-chlorid.
Daneben können sich auch verschiedene Chloroammincobalt(III)-komplexe bilden, wie Chloropentaammincobalt(III)-chlorid oder Dichlorotetraammincobalt(III)-chlorid. Teilweise fallen diese Verbindungen aus der Lösung aus. Daneben existieren auch Amminkomplexe von Cobalt(II)-salzen, wie das Hexaammincobalt(II)-sulfat, das durch Überleiten von Ammoniakgas über wasserfreies Cobalt(II)-sulfat hergestellt werden kann.
Neben den Amminkomplexen existieren eine Vielzahl von Verbindungen mit unterschiedlichen Liganden. Beispiele sind das Kaliumhexacyanocobaltat(II) (K4[Co(CN)6]), das Kaliumtetrathiocyanatocobaltat(II) (K2[Co(SCN)4]), das Kaliumhexanitritocobaltat(III) (Fischers Salz, Cobaltgelb), sowie Komplexe mit organischen Liganden wie Ethylendiamin oder dem Oxalation.
Bemerkenswert ist eine Eigenschaft von [Co(NH3)5(NO2)]Cl(NO3). Bei Bestrahlung mit UV-Licht springen die mikrometer- bis millimetergroßen Kristalle in dieser Cobalt-Koordinationsverbindung und legen dabei Distanzen zurück, die dem tausendfachen ihrer Größe entsprechen. Ursache dafür sind Isomerisierungen des Nitrit-Ligands (NO2), was zu Spannungen im Kristall führt. Diese Umwandlung von Licht- in mechanische Energie wurde von Wissenschaftlern der Vereinigten Arabischen Emirate und Russland untersucht.
Literatur
- Michael Binnewies: Allgemeine und Anorganische Chemie. 1. Auflage, Spektrum Verlag, Heidelberg 2004, ISBN 3-8274-0208-5.
- Harry H. Binder: Lexikon der chemischen Elemente – das Periodensystem in Fakten, Zahlen und Daten. S. Hirzel Verlag, Stuttgart 1999, ISBN 3-7776-0736-3.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 09.02. 2026

-thiocyanat.jpg)