Lithiumaluminiumhydrid
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
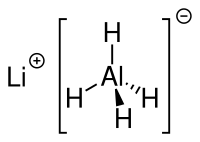
Lithiumaluminiumhydrid (LAH) ist ein anorganisches Reduktionsmittel der Summenformel LiAlH4.
Kristallstruktur
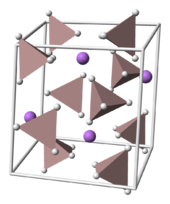
Lithiumaluminiumhydrid kristallisiert in der monoklinen Raumgruppe P21/c (Raumgruppen-Nr. 14). Die Einheitszelle besitzt folgende Strukturparameter: a = 4,8254, b = 7,8040, und c = 7,8968 Å, α = γ=90° and β=112,268° (300 K). Li+-Atome sind jeweils von fünf AlH4-Tetraedern umgeben.
Synthese
Im Labor wird Lithiumaluminiumhydrid durch Suspendieren von Lithiumhydrid und Aluminiumchlorid in Diethylether gewonnen. Nach Abfiltrieren des Lithiumchlorids und Entfernen des Ethers bleibt Lithiumaluminiumhydrid zurück.
- Synthese von Lithiumaluminiumhydrid aus Lithiumhydrid und Aluminiumchlorid
Technisch wird es außerdem auch durch Umsetzen von Natriumaluminiumhydrid mit Lithiumchlorid hergestellt. Das benötigte Natriumaluminiumhydrid kann aus den Elementen Natrium, Aluminium und Wasserstoff bei erhöhter Temperatur unter Druck erhalten werden.
Reaktionsverhalten
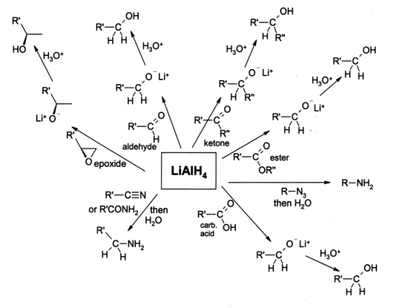
Lithiumaluminiumhydrid ist ein starkes Reduktionsmittel der organisch-synthetischen Chemie und reduziert selektiv fast alle Kohlenstoff-Heteroatom-Doppel- und -Dreifachbindungen wie beispielsweise Carbonyle oder Nitrile, es schont dagegen C=C-Doppelbindungen und C≡C-Dreifachbindungen (Alkene/Alkine), es sei denn, diese sind konjugiert zu bestimmten aktivierenden Gruppen; so wird z.B.die Gruppierung Phenyl-CH=CH-NO2 zu 2-Phenylethylamin reduziert. Es reduziert Nitroverbindungen, Amide, Azide oder Oxime zu primären Aminen, Carbonylverbindungen zu Alkoholen, Carbonsäuren, Ester, Säurechloride und Säureanhydride zu primären Alkoholen. Halogenalkane werden zu Alkanen reduziert.
| Strukturformel | ||
|---|---|---|
 | ||
| Allgemeines | ||
| Name | Lithiumaluminiumhydrid | |
| Andere Namen |
| |
| Summenformel | LiAlH4 | |
| Kurzbeschreibung | farbloses Pulver | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | 16853-85-3 | |
| EG-Nummer | 240-877-9 | |
| ECHA-InfoCard | 100.037.146 | |
| PubChem | 28112 | |
| Eigenschaften | ||
| Molare Masse | 37,95 g/mol−1 | |
| Aggregatzustand | fest | |
| Dichte | 0,92 g/cm3 (20 °C) | |
| Schmelzpunkt | 125 °C (Zersetzung) | |
| Löslichkeit |
| |
| Thermodynamische Eigenschaften | ||
| ΔHf0 |
−116,3 kJ/mol | |
Mit Wasser reagiert es heftig und stark exotherm unter Bildung von Lithiumhydroxid, Aluminiumhydroxid und Wasserstoff.
Bei Raumtemperatur ist Lithiumaluminiumhydrid metastabil. Es zersetzt sich langsam zu Lithiumhexahydridoaluminat Li3AlH6 und Lithiumhydrid, was durch Katalysatoren und Erhitzung beschleunigt werden kann.
Die thermische Zersetzung erfolgt bei höheren Temperaturen in drei Schritten. Im Temperaturbereich zwischen 150 °C und 175 °C wird zunächst unter Abspaltung von Aluminium und Wasserstoff das Lithiumhexahydridoaluminat gebildet:
ΔRH = 3,46 kJ·mol−1
Dieses zerfällt dann im Temperaturbereich zwischen 220 °C und 270 °C weiter in Lithiumhydrid, Aluminium und Wasserstoff:
ΔRH = 14,46 kJ·mol−1
Das gebildete Lithiumhydrid und Aluminium bilden dann im Temperaturbereich zwischen 585 °C und 606 °C unter weiterer Wasserstoffabgabe eine Lithium-Aluminium-Legierung.
ΔRH = 34,39 kJ·mol−1
Alle drei Teilreaktionen verlaufen endotherm.
Erst erfolgt in der Regel das Schmelzen von Lithiumaluminiumhydrid unmittelbar gefolgt von der Zersetzung zu Li3AlH6. Bei über 200 °C zerfällt dieses wiederum in Aluminium und Lithiumhydrid, die bei 400 °C zu LiAl reagieren.
Verwendung
Lithiumaluminiumhydrid wird, wie auch Natriumborhydrid,
in der Organischen
Chemie als Reduktionsmittel benutzt. Diese Verwendung als Reduktionsmittel
ist ein Beispiel für eine Synthesemethode, die mit geringer Atomökonomie abläuft.
In Verbindung mit chiralen Reagenzien, z.B.TADDOL,
ist es möglich enantioselektive
Reduktionen von Ketonen vorzunehmen.
Eine
weitere Anwendung besteht in der Synthese
von Natrium- und Kaliumaluminiumhydrid, die durch Einsatz der entsprechenden Hydride
erhalten werden können.
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- Reinhard Brückner: Reaktionsmechanismen. 3. Auflage. Spektrum Akademischer Verlag, München 2004, ISBN 3-8274-1579-9.
- Hans Beyer, Wolfgang Walter: Lehrbuch der Organischen Chemie. 19. Auflage. S. Hirzel Verlag, Stuttgart 1981, ISBN 3-7776-0356-2.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 08.05. 2025

