
Natriumaluminiumhydrid
| Sicherheitshinweise | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
Natriumaluminiumhydrid ist eine anorganisch-chemische Verbindung des Natriums aus der Stoffgruppe der Hydride.
| Strukturformel | |
|---|---|
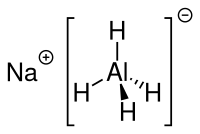 | |
| Allgemeines | |
| Name | Natriumaluminiumhydrid |
| Andere Namen |
|
| Summenformel | NaAlH4 |
| Kurzbeschreibung | weißer Feststoff |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 13770-96-2 |
| EG-Nummer | 237-400-1 |
| ECHA-InfoCard | 100.033.986 |
| PubChem | 26266 |
| Eigenschaften | |
| Molare Masse | 54,00 g/mol |
| Aggregatzustand | fest |
| Dichte | 1,27 g/cm3 |
| Schmelzpunkt | 183 °C (Zersetzung) |
| Löslichkeit |
|
Gewinnung und Darstellung
Natriumaluminiumhydrid kann direkt aus den Elementen erhalten werden. Die Reaktion hat eine sehr hohe Ausbeute, wenn sie bei einer Temperatur von 140 °C und einem Druck von 350 Bar in Toluol mit Triethylaluminium als Katalysator ausgeführt wird.
Es kann auch durch Umsetzung von Natriumhydrid mit Aluminiumchlorid in Tetrahydrofuran hergestellt werden. Bei der Reaktion wird Triethylaluminium als Katalysator eingesetzt, welches die Bildung eines löslichen Zwischenproduktes dient.
Die erste Synthese gelang 1951 durch Schlesinger und Finholt durch Reaktion von Natriumhydrid mit Aluminiumbromid in Dimethylether, wobei 60 % Ausbeute erreicht wurden.
Später verbesserten sie die Ausbeute durch Darstellung mit Aluminiumhydrids und Natriumhydrid in Tetrahydrofuran.
Ebenfalls möglich ist die Darstellung durch Reaktion von Lithiumaluminiumhydrid oder Natriumtetrachloraluminat mit Natriumhydrid.
Eigenschaften
Natriumaluminiumhydrid ist ein weißer kristalliner Feststoff, der mit Wasser heftig reagiert. Er zersetzt sich bei Erhitzung, wobei unter anderem Wasserstoff entsteht. Es ist (ähnlich wie Lithiumaluminiumhydrid) ein wirksames Reduktionsmittel, reduziert unter anderem Carbonsäureester zu Aldehyden, Lactone zu Hydroxyaldehyden.
Verwendung
Natriumaluminiumhydrid wird neben dem Einsatz als Reduktionsmittel auch zur Bestimmung kleiner Wassermengen in Ethern, Olefinen und Kohlenwasserstoffen verwendet.
Es wird auch als Speichermedium für Wasserstoff in der Fahrzeugindustrie untersucht.
Sicherheitshinweise
Bei Kontakt mit Wasser und Halogenkohlenwasserstoffen besteht Explosionsgefahr.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 06.12. 2024


