Thermodynamisches Potential
Thermodynamische Potentiale sind in der Thermodynamik
Größen, die von ihrem Informationsgehalt her das Verhalten eines thermodynamischen
Systems im Gleichgewicht
vollständig beschreiben.
Die unabhängigen
Zustandsvariablen eines thermodynamischen Potentials bezeichnet man dann als
dessen natürliche Variablen, wenn deren Ableitung des Potentials gleich einer
der abhängigen Zustandsvariablen ist (beispielsweise: ).
Ein thermodynamisches Potential entspricht vom Informationsgehalt der inneren Energie
,
deren natürliche Variablen
alle extensiv
sind (Fundamentalgleichung).
Thermodynamische Potentiale, die Energien sind, lassen sich durch Legendre-Transformation
aus der inneren Energie
herleiten, haben jedoch anders als diese eine oder mehrere intensive
Größen als natürliche Variablen
.
Die intensiven Größen entstehen bei der Koordinatentransformation
als Ableitungen
der inneren Energie nach ihren extensiven Variablen.
Daneben gibt es weitere thermodynamische Potentiale, die keine Energien sind,
beispielsweise die Entropie
.
Der Begriff des thermodynamischen Potentials wurde von Gottfried Falk zum Begriff der Massieu-Gibbs-Funktionen (nach Josiah Willard Gibbs) verallgemeinert, bei denen es sich um entsprechende Zustandsfunktionen in nicht notwendigerweise thermodynamischen Systemen handelt.
Physikalische Bedeutung
Ein Extremwert (nicht immer ein Minimum) eines thermodynamischen Potentials zeigt das thermodynamische Gleichgewicht an.
So hat sich nach dem Anschluss eines abgeschlossenen Systems an ein anderes ein thermodynamisches Gleichgewicht eingestellt, sobald die Entropie des Gesamtsystems maximal ist. In diesem Fall sind auch alle intensiven Parameter der beiden Systeme jeweils gleich:
Außerdem fassen thermodynamische Potentiale die Zustandsgleichungen des Systems zusammen, da diese durch Differenzieren eines thermodynamischen Potentiales nach seinen abhängigen Variablen zugänglich sind.
Beschreibung
Die innere Energie
und die aus ihr mittels Legendre-Transformation hervorgehenden Funktionen sind
thermodynamische Potentiale (bis auf die Ausnahme
,
s.u.). Die Legendre-Transformation transformiert die Potentiale
- von Entropie
nach Temperatur
, da
- von Volumen
nach Druck
, da
- von Teilchenzahl
nach chemisches Potential
, da
Aufgrund dieser 3 Variablenpaare gibt es
mögliche thermodynamische Potentiale:
| Name (Alternativname) | Formelzeichen | natürliche Variablen (intensive fett) |
Charakteristische Funktion f | Zusammenhänge |
|---|---|---|---|---|
| Innere Energie | (Eulergleichung für die innere Energie) | |||
| Freie
Energie (Helmholtz-Potential) |
||||
| Enthalpie | ||||
| Gibbs-Energie (Freie Enthalpie) |
||||
| - | ||||
| Großkanonisches Potential | ||||
| - | ||||
| - | Nicht sinnvoll, da die Gibbs-Duhem-Relation die unabhängige Vorgabe der Variablen |
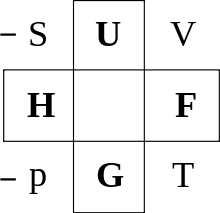
Alle sinnvollen thermodynamischen Potentiale, die aus U(S,V,N) durch Legendre-Transformation hervorgehen, liefern die gleiche, vollständige Information über ein System. Die einfachste Beschreibung des Systems liefert jedoch je nach Ensemble nur eines der Potentiale; dies ist im Gleichgewicht extremal.
Eine Möglichkeit, sich die thermodynamischen Potentiale mit ihren natürlichen Variablen zu merken, ist das Guggenheim-Quadrat.
Beispiel für Transformation
Exemplarisch soll der Wechsel von einem Potential zum anderen mittels charakteristischer Funktionen (totaler Differentiale) durchgeführt werden.
Ziel ist, von der inneren Energie U mit den natürlichen Variablen
auf ein neues Potential mit den natürlichen Variablen
zu transformieren. Wir beginnen bei der inneren Energie:
Mit
folgt
Nun bringe
auf die linke Seite:
Das neue Potential
hängt nun von den natürlichen Variablen
ab und wird „freie Energie
“
genannt. Es ist die Legendretransformierte von U(S,V,N) bezüglich der Variablen
S.
Zustandsgleichungen
Sei
ein beliebiges thermodynamisches Potential, dann kann sein totales
Differential geschrieben werden als
wobei
die natürlichen Variablen von
sind und
die jeweils dazu konjugierten Variablen.
Aus der Kettenregel folgt:
Hier ist
die Menge aller natürlichen Variablen von
ohne
.
Die
sind Ausdrücke thermodynamischer Parameter in Abhängigkeit von Ableitungen des
thermodynamischen Potentials, das von seinen natürlichen Variablen abhängt. Die
sind also gerade die Zustandsfunktionen
des Systems.
Literatur
- Ulrich Nickel: Lehrbuch der Thermodynamik. Eine anschauliche Einführung. 3., überarbeitete Auflage. PhysChem, Erlangen 2019, ISBN 978-3-937744-07-0.
- Christoph Strunk: Moderne Thermodynamik. Von einfachen Systemen zu Nanostrukturen. de Gruyter, Berlin u. a. 2015, ISBN 978-3-11-037105-5.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 16.04. 2022