Charakteristische Funktion (Physik)
Die charakteristischen Funktionen (auch charakteristische Potentialformen genannt) bezeichnen in der Thermodynamik die totalen Differentiale (Änderungen) der thermodynamischen Potentiale.
Totale Differentiale
Der inneren Energie
Aus dem Ersten und Zweiten Hauptsatz der Thermodynamik wird folgende Fundamentalgleichung für die innere Energie U hergeleitet:
Dabei ist S die Entropie,
V das Volumen, T die absolute Temperatur und p der Druck.
steht für die Stoffmenge und
für das chemische
Potential der Komponente
.
Der Enthalpie
Aus der Definition der Enthalpie H
folgt wegen >:
und mit der Fundamentalgleichung erhält man
und damit die charakteristische Funktion:
Der freien Energie
Aus der Definition der freien Energie (Helmholtz-Energie) F:
folgt
Der Gibbs-Energie
Aus der Definition der Gibbs-Energie (freien Enthalpie) G
folgt ferner
und damit die charakteristische Funktion
Des Großkanonischen Potentials
Schließlich folgt aus der Definition des Großkanonischen
Potentials
für Einstoffsysteme:
dass
Guggenheim-Schema
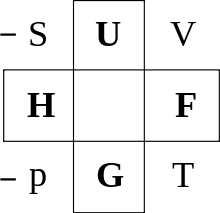
Zum praktischen Arbeiten kann man das Guggenheim-Quadrat benutzen. Hieraus erhält man alle oben genannten charakteristischen Funktionen bis auf die des Großkanonischen Potentials, welche aber sehr ähnlich der der Freien Energie ist.
Man findet die Relation, indem man das totale Differential aus der Mitte
einer der vier Seiten des Schemas entnimmt und dann aus den gegenüberliegenden
Ecken sowie den zwei benachbarten Feldern die rechte Seite abliest. Am Ende muss
man stets den Summanden
hinzufügen.
Zum Beispiel entnimmt man
aus der oberen Seite, woraus das totale Differential
der linken Seite der Gleichung folgt. Schräg gegenüber liegt dann beispielsweise
und von diesem wiederum diagonal gegenüber
,
was zum Ausdruck
führt. Analog erhält man den Summanden
mit der Besonderheit, dass, wenn der Koeffizient
des Summanden auf der linken Seite des Quadrats liegt, ein negatives Vorzeichen
vorangestellt wird. Dies gilt jedoch nur für Koeffizienten. Es ergibt sich damit
wie oben erwähnt
.
Merksprüche für das Quadrat finden sich unter: Guggenheim-Quadrat (Merksprüche)


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 18.06. 2021