
Antigen
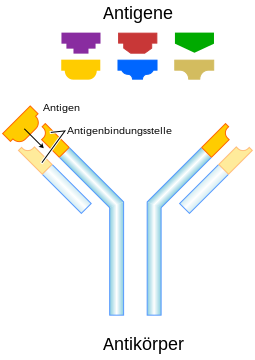
Ein Antigen (von engl. antibody-generating ‚Antikörper-erzeugend‘) ist eine molekulare Struktur, an die sich Antikörper im Rahmen einer erworbenen Immunantwort binden können. Nach der Bindung von Antikörpern an ihr jeweiliges Antigen erfolgt die erworbene Immunantwort, um gegen einen Krankheitserreger vorzugehen. Es kann sich bei den Antigenen zum Beispiel um Proteine, Lipide oder Kohlenhydrate handeln, nicht jedoch um Monosaccharide, Disaccharide, Aminosäuren oder einzelne Fettsäuren, weil derartige kleine Moleküle in der Regel keine Bindung zum Antikörper etablieren können (siehe Haptene).
Ursprünglich wurde der Begriff nur auf Substanzen angewendet, die nach Injektion in einen fremden Organismus zur Antikörperbildung führten. Heute umfasst die Definition Moleküle, die spezifisch von Antigenrezeptoren von B- und T-Zellen gebunden werden. Außer Antikörpern können sich auch Lymphozyten über B-Zell-Rezeptoren oder T-Zell-Rezeptoren an Antigene binden, wodurch die Bildung von Antikörpern verstärkt wird oder Zytotoxische T-Zellen gebildet werden.
Eigenschaften
Die spezifische Bindung von Antikörpern und Antigenrezeptoren an Antigene ist ein wesentlicher Teil der adaptiven Immunität (auch erworbene Immunität) gegen Pathogene (Krankheitserreger). Dieser Teil des Immunsystems wird als adaptiv bezeichnet, weil die Antigen-bindenden Proteine des Immunsystems für eine bessere Bindung an das Antigen angepasst werden. Als erworben wird dieser Teil bezeichnet, weil erst nach einem ersten Kontakt eine adaptive Immunantwort entsteht – im Gegensatz zur angeborenen Immunantwort. Die Stelle auf der Oberfläche eines Antigens, die von einem Antikörper erkannt wird, wird als Epitop bezeichnet. Ein Antigen kann mehrere Epitope besitzen. An dieses Epitop bindet ein Antikörper mit dem sogenannten Paratop, der gegenüberliegenden passgenauen Stelle auf der Oberfläche des Antikörpers. Die Bindung eines Antikörpers an sein Antigen wird auch als Antigen-Antikörper-Reaktion bezeichnet. Ein Antikörper bindet nur an ein bestimmtes Epitop, je nach Aufbau des Paratops.
Immunogenität
Antigene können eine Immunantwort auslösen und damit immunogen wirken – oder auch tolerogen (toleranzbildend) wirken und in Folge keine Immunantwort auslösen. Beispielsweise müssen Krankheitserreger vom Immunsystem erkannt und eliminiert werden, nicht aber harmlose (z. B. Nahrungsmittel) oder körpereigene Moleküle. Antigene, die von Antikörpern oder B-Zell-Rezeptoren gebunden werden, sind meistens Proteine, können aber auch Kohlenhydrate, Lipide, Nukleinsäuren oder andere Stoffe sein. Dagegen werden von T-Zell-Rezeptoren meistens Proteinfragmente (Peptide) gebunden.
Epitopwiederholungen
Normalerweise kommt ein Epitop nur einmal auf einem Antigen vor. Diese Epitope werden als monovalent (einwertig) bezeichnet. Bei Polymeren wie Nukleinsäuren und Polysacchariden sowie bei räumlich gruppierten gleichen Antigenen (wie beispielsweise gleiche Membranproteine auf einer Zelloberfläche) kommen gleiche Epitope auch mehrfach nah beieinander vor. In diesem Fall werden sie als polyvalent (mehrwertig) bezeichnet, was sich in einer Erhöhung der Avidität, einer Gruppierung von B-Zell-Rezeptoren zu Clustern und somit in einer Aktivierung von B-Zellen äußert.
Niedermolekulare Verbindungen
Nicht jedes Antigen ist auch immunogen; beispielsweise wirken zu kleine Moleküle (darunter die Haptene) nicht immunogen. Bestimmte niedermolekulare Stoffe, die alleine keine Antikörperreaktion hervorrufen können, sondern erst durch die Bindung an ein Trägerprotein eine Immunreaktion auslösen können, heißen Haptene. Diese Haptene waren bei der Erforschung der Bindung durch Antikörper an ein Antigen wichtig, indem sie als chemisch definierte und veränderbare Versuchsobjekte dienten. Dementsprechend wird eine (meist höhermolekulare) Substanz, die diese Reaktion alleine ermöglicht, als Vollantigen bezeichnet, ein Hapten als Halbantigen. Kleine Moleküle wie Monosaccharide, Amino- oder Fettsäuren können keine adaptive Immunreaktion bewirken.
Spezifität
Damit ein Antigen immunogen ist, muss es zunächst von B- oder T-Zellen erkannt werden. Jede dieser Zellen bindet spezifisch nur ein Antigen mit ihrem jeweiligen Rezeptor nach der Klon-Selektionstheorie. Gelegentlich kommt es zu einer Bindung von Molekülen, die strukturell sehr ähnlich sind (Kreuzreaktivität). Antigene können entweder von B-Zell-Rezeptoren, T-Zell-Rezeptoren oder (von B-Zellen produzierten) Antikörpern erkannt bzw. gebunden werden. Für die Einleitung einer Immunantwort muss generell zusätzlich zum präsentierten Antigen zweiter Mechanismus aktiviert werden (ein Kostimulator auf der präsentierenden Zelle bindet an sein Gegenstück auf der Immunzelle). Bei Impfstoffen wird dieses zweite Aktivierungssignal teilweise durch Zugabe von Adjuvanzien erreicht. Eine Ausnahme bilden die Superantigene, welche zur Aktivierung der adaptiven Immunantwort kein zweites Aktivierungssignal benötigen.
Bindungsstärke
Antigene erzeugen je nach Stärke der Bindung an Teile des Immunsystems unterschiedlich starke Immunreaktionen. Die Bindung von Antigenen ist reversibel und ohne kovalente Bindung. Sie erfolgt über elektrostatische Wechselwirkungen, Wasserstoffbrückenbindungen, Van-der-Waals-Kräfte und hydrophobe Wechselwirkungen. Die Stärke der Bindung wird als Affinität bezeichnet, und typische Werte für Antikörperbindungen liegen zwischen 10−7 bis 10−11 M. In Blut und Lymphe kommen Millionen verschiedene Antikörper mit unterschiedlichen Affinitäten und unterschiedlichen Epitopen vor, aber jeder Antikörper bindet nur ein Epitop.
Die Epitope, die eine stärkere Immunantwort erzeugen, werden als immundominant bezeichnet. Oftmals kommt es vor, dass sich Antigene von Krankheitserregern verändern, die zuvor gut vom Immunsystem erkannt wurden. Da durch eine starke adaptive Immunantwort gleichzeitig auch ein starker negativer Selektionsdruck auf die Epitope ausgeübt wird, kommt es häufiger im Zuge einer Immunevasion zu solchen Veränderungen, die sich in der Ausbildung von Fluchtmutationen von Krankheitserregern äußern, wodurch die Antigene verändert sind und schlechter oder gar nicht mehr vom Immunsystem erkannt werden.
Gegenseitige Hemmung
Wenn mehrere Epitope nahe beieinander liegen, kann die Bindung eines Antikörpers, B- oder T-Zell-Rezeptors an das erste Epitop räumlich die Bindung eines zweiten Antikörpers, B- oder T-Zell-Rezeptors an ein in direkter Nachbarschaft liegendes zweites Epitop behindern (sterische Hemmung). In seltenen Fällen kann die Bindung eines Antikörpers, B- oder T-Zell-Rezeptors eine Konformationsänderung im Antigen hervorrufen, wodurch ein anderes Epitop mit verändert wird und nicht mehr erkannt wird (allosterische Hemmung).
Selbst- und Fremderkennung
Körpereigene Antigene (Autoantigene) sind prinzipiell tolerogen, neu auftretende Antigene (darunter Neoantigene von Tumoren) sind potentiell gefährlich. Auch die Strukturen auf den Zellen eines fremden Menschen werden als körperfremd erkannt, denn die Kombination der Proteine auf den Zelloberflächen (Zellmembran) ist bei jedem Menschen anders. Daher wirken sich diese menschlichen Antigene bei der Übertragung von organischem Material von einem Menschen auf einen anderen nachteilig aus, z.B. bei der Bluttransfusion oder Organtransplantation. Hier muss auf Blutgruppen- bzw. Gewebeverträglichkeit geachtet werden. Die Übertragung falscher Blutgruppen führt zur Verklumpung des Blutes, bei Transplantationen kann es zur Abstoßungsreaktion gegen das übertragene Organ oder zur Schädigung des Empfängers durch das transplantierte Organ kommen (Graft-versus-Host Disease). Damit körpereigene oder harmlose Stoffe nicht als Antigene erkannt werden, wird eine Immuntoleranz ausgebildet. Dennoch kommt es gelegentlich zu Fehlreaktionen, wie Autoimmunerkrankungen (z.B. durch Autoantikörper), Immunpathogenesen oder Allergien. Antigene, die Allergien auslösen können, werden Allergene genannt. Auch körpereigene Strukturen können als Antigene wirken, wenn sie fälschlicherweise als fremd angesehen werden. Antigene werden unter anderem zur Entwicklung von Impfstoffen gegen Pathogene oder Tumoren (Tumorantigene und Tumor-assoziierte Antigene) eingesetzt oder werden vor einer Bluttransfusion oder Organtransplantation untersucht, um eine Immunreaktion gegen fremde Blutgruppen bzw. eine Abstoßungsreaktion zu vermeiden.
Antigenpräsentation
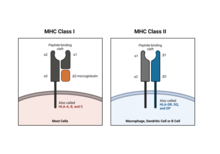
Für die Darbietung der Antigene sorgt die Antigenpräsentation. Die Optimierung der Bindung durch B- oder T-Zellen erfolgt durch zwei Mechanismen: die V(D)J-Gen-Umlagerung und die somatische Hypermutation(nur bei B-Zellen). Die entsprechenden Rezeptoren der Lymphozyten werden je nach Art der Lymphozyten als B-Zell-Rezeptoren oder T-Zell-Rezeptoren bezeichnet. Die Optimierung auf ein bestimmtes Epitop hat einen prägenden Einfluss auf die Immunantwort gegen dieses Epitop, der sich in einer schwächeren Immunantwort gegen mutierte Epitope bei einem erneuten Kontakt äußert, z.B. mit Virusvarianten (Antigenerbsünde). Während B-Zellen Antigene in voller Länge erkennen können (native Antigene), müssen Antigene für T-Zellen erst durch proteinabbauende Enzyme in Peptide zerlegt und an einem Präsentationsmolekül (MHC-I oder MHC-II) auf der Zelloberfläche präsentiert werden.
B-Zell-Antigene
Antigene, die von B-Zell-Rezeptoren oder Antikörpern erkannt werden, befinden sich oftmals auf den Oberflächen von eingedrungenen Fremdkörpern (z.B. auf Pollenkörnern, Bakterienoberflächen und im Kot von Hausstaubmilben) oder Zellen und weisen dort eine dreidimensionale Struktur auf, die spezifisch von bestimmten B-Zellen oder Antikörpern erkannt werden kann. Antigene auf Zelloberflächen werden als Oberflächenantigene bezeichnet.
B-Lymphozyten (B-Zellen), die sich mit ihrem B-Zell-Rezeptor (der membranständige Vorläufer des Antikörpers) an ein Antigen gebunden haben, werden je nach Antigen entweder direkt (TI-antigen) oder mit Hilfe einer T-Helferzelle aktiviert. T-Helferzellen, die sich an einen Antigen-MHC-Komplex gebunden haben und das Antigen als fremd erkannt haben, scheiden Cytokine aus, die B-Zellen zur Antikörperproduktion anregen. Je nachdem, welche Cytokine in der Umgebung ausgeschüttet werden, findet ein Klassenwechsel in eine der Antikörper-Klassen (IgG, IgE, IgA) statt. Antikörper werden von den Plasma-Zellen (aktivierte B-Zellen) sezerniert, binden spezifisch an das Antigen, markieren damit den Eindringling (Opsonisierung) und führen so zur Phagocytose der Fremdkörper. Diese Aufgabe übernehmen beispielsweise Makrophagen, die sich mit ihren Fc-Rezeptoren an die konstante Region der Antikörper binden. Durch die Erkennung körperfremder Antigene können gezielt Eindringlinge wie Bakterien oder Viren bekämpft werden, ohne körpereigene Zellen zu schädigen.
Bei den meisten B-Zell-Antigenen ist eine parallele Präsentation von T-Zell-Antigenen auf MHC-II gegenüber T-Helferzellen für eine humorale Immunantwort notwendig (Thymus-abhängige Antigene). Einige wenige B-Zell-Antigene können Antikörper auch ohne eine Aktivierung von T-Helferzellen hervorrufen (T-unabhängige Antigene, engl. TI-Antigens).
T-Zell-Antigene
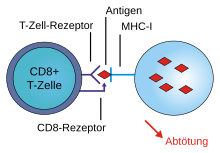
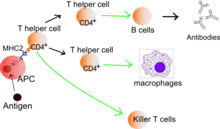
Antigenpräsentierende Zellen für MHC-I sind alle kernhaltigen Zellen, während die für MHC-II vorwiegend Dendritische Zellen sind. Professionelle Antigen-präsentierende Zellen (prAPC) sind spezialisierte Zellen des Immunsystems, die den T-Zellen Antigene präsentieren. Zu den prAPCs gehören Dendritische Zellen, Makrophagen und B-Zellen. Sie nehmen Substanzen über verschiedene Mechanismen wie beispielsweise durch Endozytose auf, verarbeiten sie und koppeln sie an MHC-Moleküle. Diese werden dann auf der Zellmembran präsentiert. Eine T-Zelle mit einem passenden T-Zell-Rezeptor (TCR) kann das Antigen dann als fremd erkennen und wird aktiviert, wenn auch weitere kostimulatorische Signale vorliegen. T-Lymphozyten (T-Zellen) erkennen Antigene nur, wenn diese auf den Oberflächen von anderen Zellen an MHC präsentiert werden.
Zytotoxische T-Zellen können an Antigene binden, die von MHC-I präsentiert werden und durchschnittlich aus 8–10 Aminosäuren bestehen. Die präsentierende Zelle wird im Anschluss durch Perforine und Granzym B zerstört. Eine Untergruppe der MHC-I (CD1) präsentiert nicht Peptide, sondern Lipide als Antigene. Ein MHC-I-ähnlicher Rezeptor (MR-1) präsentiert Metaboliten von bakteriellen Vitaminsynthesen, darunter Stoffwechselprodukte aus der bakteriellen Herstellung von Riboflavin.
Antigene, die dagegen von Rezeptoren der T-Helferzellen erkannt werden, sind Peptidsequenzen aus circa 12–24 Aminosäuren, die von antigenpräsentierenden Zellen (APC) aufgenommen und auf MHC-II an der Zelloberfläche präsentiert werden. Durch die Präsentation auf MHC-II wird über die Aktivierung von T-Helferzellen anschließend die Bildung von Antikörpern durch B-Zellen verstärkt.
Verwendung
Antigene werden routinemäßig bei der Diagnostik von Infektionskrankheiten, Allergien und Autoimmunerkrankungen untersucht. Die quantitative Bestimmung eines nativen Antigens erfolgt meistens per ELISA. Als qualitative Nachweise werden auch Schnelltests verwendet. Eine Bestimmung von immunogenen und tolerogenen Epitopen (kurze Peptide) wird dagegen meistens im Rahmen einer Epitopkartierung per EliSPOT, per release assay oder Tetramerfärbung durchgeführt.
Geschichte
Die Bezeichnung „Antigen“ wurde in Anlehnung an den von Paul Ehrlich> geprägten Begriff Antikörper erstmals ab 1899 von László Detre verwendet. Im Jahr 1903 veröffentlichte er gemeinsam mit Elie Metchnikoff eine Schrift in französischer Sprache, in der Antigene als substances immunogènes ou antigènes (deutsch ‚immunogene oder antigene Substanzen’) definiert wurden. Für ihre Entdeckungen „zur Spezifität der zellulären Immunantwort“ (MHC-Restriktion) erhielten Peter C. Doherty und Rolf Zinkernagel 1996 den Nobelpreis für Physiologie oder Medizin.
Literatur
- C. Janeway et al: Immunobiology. 6. Auflage. ISBN 0-8153-4101-6. Die 5. englische Ausgabe ist online auf den Seiten des
NCBI-Bookshelf frei verfügbar,
 (online).
(online).


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 15.09. 2025