| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
| Toxikologische Daten | ||||||||
Beryllium ist ein chemisches Elementmit dem Symbol Be und der Ordnungszahl 4. Der Name lässt sich vom Mineral Beryll, einem berylliumhaltigen Schmuckstein, ableiten (altgriechisch: βήρυλλος beryllos, lateinisch: beryllus). Im Periodensystem steht Beryllium in der zweiten Hauptgruppe und zählt daher zu den Erdalkalimetallen. Als Element der zweiten Periode zählt es zu den leichten Erdalkalimetallen. Bemerkenswert ist jedoch, dass es eine höhere Dichte als seine beiden Homologen Magnesiumund Calciumhat. Das stahlgraue Leichtmetall ist sehr hart und spröde und wird meist als Legierungszusatz verwendet. In Verbindungen ist es zweiwertig.
Geschichte

Durch einen Hinweis von Abbé R. J. Haüy isolierte der französische Chemiker Louis-Nicolas Vauquelin 1798 das Beryllium in Form seines Oxidsaus den Edelsteinen Beryll und Smaragd. Kurz darauf stellte Martin Heinrich Klaproth die gleiche Verbindung her, welche er Beryllium (nach dem Mineral Beryll) nannte.
Das chemische Symbol Be wurde 1814 von J.J. Berzelius eingeführt.
Erst 1828 gelang es Friedrich Wöhler und Antoine Bussy, das Element durch die Reduktion des Berylliumchlorids mit Kalium darzustellen.
Reines Beryllium wurde erstmals 1899 von Paul Marie Alfred Lebeau durch Schmelzflusselektrolyse von Natriumtetrafluoridoberyllat (Na2[BeF4]) hergestellt.
Wegen des süßen Geschmackes der Berylliumsalze wurde in Frankreich noch bis 1957 Vauquelins Namensvorschlag Glucinium (griech. γλυκύς = süß) verwendet.
Im Altertum und Mittelalter dienten durchsichtige Beryllstücke vielfach als Zauberglas, da es, wie heute eine Lupe, Schriftzüge und Bilder beim Lesen vergrößert. Vom Wort Beryll leitet sich die Bezeichnung Brille (lat. berillus) ab, ursprünglich für ein Augenglas aus Beryll. 1945 wurde Beryllium zusammen mit dem Alphastrahler Polonium als Neutronenquelle in der Atombombe Little Boy, die über Hiroshima abgeworfen wurde, eingesetzt.
Vorkommen
Mit einem Massenanteil von 5,3 ppm in der Erdhülle steht Beryllium an 48. Stelle der Elementhäufigkeit. Das seltene Element kommt in rund 30 verschiedenen Mineralien vor. Die wichtigsten sind Bertrandit (4 BeO·2 SiO2·H2O) (Vereinigte Staaten) und Beryll (Be3Al2(SiO3)6) (Volksrepublik China, Russland und Brasilien). Die schönsten und wertvollsten beryllhaltigen Mineralien sind die Schmuck- und Edelsteine Aquamarin, Smaragd, Roter Beryll, Euklas, Gadolinit, Chrysoberyll, Phenakit und Alexandrit. Berylliumerz-Lagerstätten finden sich bevorzugt im Äquatorialgürtel. Frühere, mittlerweile erschöpfte Lagerstätten lagen nördlich zu Fuße der Hohen Tauern um Bramberg in Österreich. In den USA werden niedrighaltige Lagerstätten von Berylliumoxid-Erz in der Nevada-Wüste abgebaut. Die geschätzten Vorräte an förderbarem Beryllium liegen weltweit bei etwa 80.000 t.
Herstellung
Elementares Beryllium lässt sich durch Reduktion von Berylliumfluorid mit Magnesium bei 900 °C herstellen.
Die Herstellung hochreinen, metallischen Berylliums erfolgt durch Schmelzflusselektrolyse von Berylliumchlorid oder -fluorid:
Die Weltjahresproduktion an Beryllium-Metall betrug 2004 etwa 100 t.
Eigenschaften

Beryllium besitzt für ein Leichtmetall einen bemerkenswert hohen Schmelzpunkt. Neben der sehr hohen spezifischen Wärmekapazität von 1,825 kJ/(kg·K) besitzt es einen um ein Drittel höheren Elastizitätsmodul als Stahl; die Schwingungsdämpfung ist ebenfalls sehr hoch. Da es nur vier Elektronen pro Atom hat, ist es sehr durchlässig für Röntgenstrahlen. Alphastrahlung kann aus Beryllium Neutronen freisetzen:
Bei Raumtemperatur ist Beryllium an trockener Luft beständig, es bildet sich eine passivierende Oxidschicht, die dem Angriff kalter konzentrierter Salpetersäure widersteht. In Salzsäure wird es jedoch schnell angegriffen. An feuchter Luft überzieht es sich mit einer Schicht aus Hydroxid, die sich beim Kontakt mit Wasser ausbildet. Bei höheren Temperaturen ist die Korrosionsbeständigkeit in Wasser abhängig von den Verunreinigungen des Metalls sowie des Korrosionsmediums, zusätzlich besteht die Gefahr der Lochfraßkorrosion. Alkalilaugen greifen Beryllium unter Bildung von Beryllaten an. In heißen Gasen wie Luft, Sauerstoff, Stickstoffund Kohlenstoffdioxid tritt merkliche Korrosion erst oberhalb von 600 °C ein.
Beryllium hat eine außerordentlich niedrige Poissonzahl von µ = 0,032, weist also im Zugversuch eine sehr geringe Querkontraktion auf, während andere Element-Metalle Werte von µ = 0,21 (Chrom) bis 0,44 oder 0,45 (Gold, Blei; Thallium) aufweisen.
Isotope
Beryllium besitzt nur ein stabiles Isotop: 9Be. Die radioaktiven Isotope 7Be und 10Be sind kosmogen auf der Erde in Spuren vorhanden.
Der Nachweis von 10Be hat wissenschaftliche Anwendungen zum Beispiel in der Geologie und Klimaforschung. Eine wichtige Anwendung in der Geologie ist die Datierung der Offenlegung von Gestein; damit lässt sich zum Beispiel der Rückzug von Gletschern datieren. Die Konzentration von 10Be zeigt eine Korrelation mit der die Erde erreichenden kosmischen Strahlung. Diese hängt von der Stärke des Erdmagnetfeldes und der Sonnenaktivität ab (hohe Be-Konzentration bei geringer Sonnenaktivität). Da es sich bevorzugt auf Aerosoloberflächen niederschlägt, korrelieren hohe Be-Konzentrationen auch mit hohen Aerosolkonzentrationen in der Luft. Hohe Konzentrationen treten in Warmzeiten, geringe in Kaltzeiten auf. Da 10Be zusammen mit den übrigen Gasen der Atmosphäre in Eisbohrkernen eingeschlossen wird, kann durch Analyse dieser Einschlüsse auch über viele Jahrtausende der Zusammenhang zwischen Sonnenaktivität und globalem Temperaturverlauf analysiert werden.
Das extrem kurzlebige Isotop 8Be (Halbwertszeit etwa 10−17 Sekunden) spielt eine wichtige Rolle in der Nukleosynthese, der Entstehung der chemischen Elemente in Gestirnen.
An dem kurzlebigen Isotop 11Be wurde 2008 eine kernphysikalisch interessante Besonderheit nachgewiesen: Sein Atomkern besteht aus einem relativ kompakten Rumpfkern und einem einzelnen, locker gebundenen Neutron, das diesen als Halo umgibt.
| Eigenschaften | |
|---|---|
| Allgemein | |
| Name, Symbol, Ordnungszahl | Beryllium, Be, 4 |
| Serie | Erdalkalimetalle |
| Gruppe, Periode, Block | 2, 2, s |
| Aussehen | weiß-grau metallisch |
| CAS-Nummer | |
| EG-Nummer | 231-150-7 |
| ECHA-InfoCard | |
| Massenanteil an der Erdhülle | 5,3 ppm |
| Physikalisch | |
| Aggregatzustand | fest |
| Kristallstruktur | hexagonal (dichtest gepackt) |
| Dichte | 1,848 g/cm3 (20 °C) |
| Mohshärte | 5,5 |
| Magnetismus | diamagnetisch
(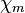 = −2,3 · 10−5)
= −2,3 · 10−5) |
| Schmelzpunkt | 1560 K (1287 °C) |
| Siedepunkt | 3243 K (2969 °C) |
| Molares Volumen | 4,85 · 10−6 m3/mol |
| Verdampfungswärme | 309 kJ/mol |
| Schmelzwärme | 7,95 kJ/mol |
| Schallgeschwindigkeit | 13000 m/s |
| Spezifische Wärmekapazität | 1825 J/(kg · K) |
| Elektrische Leitfähigkeit | 25 · 106 A/(V · m) |
| Wärmeleitfähigkeit | 190 W/(m · K) |
| Chemisch | |
| Oxidationszustände | 2 |
| Oxide (Basizität) | BeO (amphoter) |
| Normalpotential | −1,97 V (Be2+ + 2 e− → Be) |
| Elektronegativität | 1,57 (Pauling-Skala) |
Verwendung
Halbzeuge und Rohteile aus Berylliummetall werden vielfach als Sinterprodukte pulvermetallurgisch in HIP- und CIP-Verfahren hergestellt (heiß- und kaltisostatisches Pressen). Gussteile aus Beryllium finden wegen der anisotropen Eigenschaften und anderer Merkmale, wie Grobkörnigkeit, keine technische Verwendung. Prozesse für die Herstellung von Berylliummetall und für das Legieren mit Kupfer oder/und Nickel verwenden Berylliumhydroxid und Berylliumoxid als Ausgangsstoff.
Trotz der herausragenden Eigenschaften des Berylliums ist es wegen seines hohen Preises und seiner Toxizität nur für wenige Anwendungen im Einsatz. Es findet Verwendung:
- als Konstruktionswerkstoff in Legierungen mit Aluminium für beanspruchte und sehr leichte Produkte in der Flugzeug- und Weltraumtechnik. Beralcast (früher Lockalloy) und AlBeMet-AM162 (62 % Be, 38 % Al) sind Markennamen für Feinpulver, aus denen die Bauteile durch heißisostatisches Pressen hergestellt werden.
- als Legierungsbestandteil in Berylliumkupfer (CuBe, CuCoBe). Daraus werden unter anderem funkenfreie, nichtmagnetische Werkzeuge hergestellt, die in explosionsgefährdeten Bereichen eingesetzt werden können. Kontakt- und Federwerkstoffe aus Berylliumkupfer zeichnen sich durch hohe Härte, Elastizität, Zugfestigkeit, Ermüdungsfestigkeit, Korrosionsbeständigkeit, Nichtmagnetisierbarkeit sowie gute elektrische und thermische Leitfähigkeit aus. Berylliumkupfer kann daher für Oberleitungen, Kontaktfedern oder andere Strom übertragende Federn, z.B. in Drehspulmesswerken oder an Kohlebürsten eingesetzt werden, ebenso für nichtmagnetisierbare Werkzeuge zum Einsatz in starken Magnetfeldern, beispielsweise zu Arbeiten an Magnetresonanztomographie-Geräten. Zu finden ist Berylliumkupfer auch in Präzisions-Sockeln für Integrierter Schaltkreise.
- als Legierungsbestandteil mit Anteilen von etwa 0,0001-0,1 Gew.-% zur Verbesserung der Festigkeit und des Dehnungsverhaltens von Feinstdrähten ("Bonddrähten") aus Gold, die in der Halbleiterindustrie zum Kontaktieren von Bauelementen auf einem Verdrahtungsträger genutzt werden.
- als reines Metall
- in „Fenstern“ von Röntgenröhren, Röntgen- und Gammastrahlungsdetektoren wegen der Durchlässigkeit für diese Strahlen, insbesondere die weichen (niederenergetischen) Anteile;
- für Moderatoren und Neutronenreflektoren in Kernreaktoren und Kernwaffen;
- in Kernfusionsanlagen wie JET (Joint European Torus) wegen des hohen Schmelzpunktes und der kleinen Ordnungszahl als Plasmabegrenzung (englisch: limiter);
- zur Neutronenvermehrung im Brutmantel (Blanket) zukünftiger Fusionsreaktoren mittels der (n,2n)-Kernreaktion
-
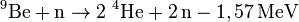 .
.
Weitere Anwendungen:

- Berylliumkupfer(CuBe)-Ventilführungen und -Ventilsitze im Motorenbau
- CuBe- und CuCoBe-Elektroden für das Punktschweißen und für Kunststoffspritzdüsen
- Relaiskontakte aus CuBe und CuCo
- Bananenstecker (Hohlbananas) aus CuBe
- Primär- und Fangspiegel des Spitzer-Weltraumteleskops sind aus verspiegeltem Beryllium
- Uhrenfedern aus Eisen-Nickel-Beryllium, NiBe
- Bremsscheiben des Space Shuttles (geringes Gewicht und hohe Wärmekapazität) aus Berylliummetall
- Rotoren in Kreiselkompassen, bewegliche Spiegel in optischen Systemen, Antriebssysteme in Magnetbandgeräten
- Nickel-Beryllium-Legierungen für temperaturbelastete Verbindungselemente wie Thermostatschalter
- Nickel-Beryllium-Werkzeuge wegen Anti-Klebeneigung für sekundäre Bor-Silikat-Gläser und optische Mehrfocalglaslinsen
- Neutronenquellen (zusammen mit einem Alphastrahler, siehe oben)
- Berylliumoxid als gut wärmeleitender Isolator für Hochfrequenz-Leistungstransistoren, -Zirkulatoren und -Hochlastwiderstände. Wegen der Giftigkeit wird BeO, wenn möglich, durch Aluminiumoxid, Bornitrid oder Aluminiumnitrid ersetzt
- Hochtöner von High-End-Lautsprechern versuchsweise aus Beryllium-Metall (Yamaha Corporation), Kalotten-Membran für ultra-hohe Töne; inzwischen erfolgreich für High-End-Hochtonkalotten in Serienproduktion (FOCAL TBe-Linie)
- Mercedes-Ilmor, Lieferant des McLaren-Formel 1-Teams, verwendete diesen Werkstoff beim Motorenbau. Der Werkstoff wurde nach einem Protest von Ferrari verboten. Als Begründung wurde genannt, dass der Werkstoff bei der Bearbeitung gesundheitsschädlich ist
- Der aus hexagonalen Segmenten aufgebaute Hauptspiegel des James Webb Space Telescope besteht aus Beryllium.
- Beryllium findet beim Forschungszentrum CERN Verwendung als Baumaterial für ultraharte und vakuumdichte Röhren des Large Hadron Colliders, in welchen Protonen gezielt zur Kollision gebracht werden.
Sicherheitshinweise

Beryllium, Berylliumoxid und Berylliumsalze sind giftig und karzinogen. Beryllium kann zu Haut-, Lungen-, Milz- und Leberschäden führen.
Beryllium akkumuliert sich im menschlichen Körper und führt nach jahrelanger Latenzzeit zur Bildung von Tumoren. Gefährlich ist vor allem inhaliertes Beryllium, es führt zur Berylliose. Hierbei kommt es in der Lunge zur Bildung von charakteristischen Epitheloidzellgranulomen. Verschlucktes Beryllium ist relativ ungefährlich, da es überwiegend wieder ausgeschieden wird. Bei der Berylliumverarbeitung ist Absaugung und Abkapselung bei der Spanabnahme unbedingt erforderlich. Bei der Zerstörung berylliumoxidhaltiger elektronischer Bauteile kann Berylliumoxid freigesetzt werden, sie müssen daher entsprechend gekennzeichnet sein, was aber, insbesondere bei älteren Bauteilen, oft nicht der Fall ist.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 20.12. 2023


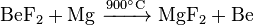
![\mathrm{BeCl_2 \ \xrightarrow[Elektrolyse]{405^{\circ}C}\ Be + Cl_2 \uparrow}](/png/2080ebcb4850181a96bce0c3299b4c3d.png)