
Thiamin
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| Toxikologische Daten | |||||||||
Thiamin oder Vitamin B1 (veraltet: Aneurin) ist ein wasserlösliches Vitamin aus dem B-Komplex von schwachem, aber charakteristischem Geruch und ist insbesondere für die Funktion des Nervensystems unentbehrlich. Wird das Vitamin B1 für ca. 14 Tage dem Körper nicht mehr zugeführt, sind die Reserven zu 50 % aufgebraucht.
| Strukturformel | |
|---|---|
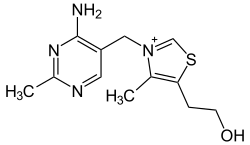
| |
| Struktur von Thiaminchlorid | |
| Allgemeines | |
| Trivialname | Vitamin B1 |
| Andere Namen |
|
| Summenformel |
|
| CAS-Nummer |
|
| ATC-Code | A11DA01 |
| Kurzbeschreibung | farbloses Pulver, charakteristischer Geruch |
| Vorkommen | siehe Tabelle im Artikeltext |
| Physiologie | |
| Funktion | Kohlenhydratstoffwechsel, Coenzym bei dehydrierenden Decarboxylierungsreaktionen (z.B. im Pyruvatdehydrogenasekomplex) |
| Täglicher Bedarf | 1,0–1,2 mg |
| Folgen bei Mangel | Muskelatrophie, Herzinsuffizienz, neurologische Störungen, Beriberi, Wernicke-Enzephalopathie |
| Überdosis | nicht bekannt |
| Eigenschaften | |
| Molare Masse | 337,27 g/mol (Hydrochlorid) |
| Aggregatzustand | fest |
| Schmelzpunkt | |
| Löslichkeit | sehr gut löslich in Wasser (500 g/l) |
Chemische Struktur
Thiamin besteht aus zwei Ringsystemen, die durch eine Methylenbrücke miteinander verbunden sind: einem Pyrimidin- und einem Thiazolring.
Funktion
Thiamin wird im Darm über den aktiven Thiamintransporter und in hohen Konzentrationen vorliegend auch durch Diffusion aufgenommen. Es existieren seltene erbliche Mangelkrankheiten dieser Proteine. Bei der Thiamin-responsiblen, megaloblastären Anämie (TRMA) kommt es durch Mutationen im SLC19A2-Gen zur Funktionsunfähigkeit des aktiven Thiamintransporters. Hierdurch kann das in der Nahrung in niedrigen Konzentrationen vorliegende Thiamin nicht mehr ausreichend aufgenommen werden. Dies führt zum charakteristischen Krankheitsbild der TRMA mit einem Diabetes mellitus, Schwerhörigkeit und einer megaloblastären Anämie. Unbehandelt führt die TRMA zum Tode. Durch Verabreichung einer hohen Dosis von Thiamin kann ausreichend Thiamin über den Darm durch Diffusion aufgenommen werden.
Thiamin selbst wird im Körper nicht verwendet. Mithilfe des Enzyms Thiaminpyrophosphokinase wird es zunächst zu Thiaminpyrophosphat (TPP) umgewandelt. In dieser biologisch aktiven Form ist es Coenzym verschiedener Enzyme, wie beispielsweise der Pyruvatdehydrogenase E1 des Pyruvatdehydrogenase-Komplexes (PDC) bzw. der α-Ketoglutarat-Dehydrogenase des α-Ketoglutarat-Dehydrogenase-Komplexes (OGDC), oder der Transketolase im Pentosephosphatzyklus.
Glucosestoffwechsel und Mitochondrien
Mittels PDC wird in den Mitochondrien Pyruvat zu Acetyl-CoA umgebaut. TPP dient diesem Enzymkomplex als Coenzym bei der Abspaltung von CO2 und macht damit die aerobe Verwertung von Glucose (und damit auch anderer Kohlenhydrate) erst möglich.
Ist dieser Stoffwechselweg blockiert, wird im Cytosol aus Pyruvat durch Milchsäuregärung Lactat erzeugt, was eine vergleichsweise ineffiziente Form der Energiegewinnung darstellt.
Verluste in Nahrungsmitteln
Thiamin ist hitzeempfindlich, es wird durch Kochen zerstört. Es ist wasserlöslich, dadurch gehen beim Kochen in Wasser etwa 30 % ins Kochwasser verloren. In rohem Fisch und Farnen ist das Enzym Thiaminase enthalten, das Thiamin abbaut und somit vernichtet. Konservierungsstoffe aus der Gruppe der Sulfite (E 220 – E 228) zersetzen ebenfalls Thiamin. Zudem ist es UV- und O2-empfindlich.
Bei der Herstellung von weißem Mehl (z.B. Typ 405) oder weißem Reis wird der braune Keim der Pflanze vom Rest des Samens (Endosperm) entfernt. Der Keim enthält jedoch das gesamte Vitamin B1 des Samens, welches zur Verbrennung der enthaltenen Kohlenhydrate benötigt wird.
Im Gegensatz dazu bleibt in Vollkornmehl, braunem Reis oder parboiled Reis das Vitamin B1 weitestgehend enthalten.
Anreicherung in Lebensmitteln
Um den Verlust bei der Verarbeitung auszugleichen, wird in vielen Ländern dem Mehl und Reis das Vitamin B1 wieder künstlich zugesetzt. Inzwischen verfahren 71 Länder bei Mehl so, darunter Großbritannien, USA und Kanada, jedoch nicht Deutschland. Thiaminhydrochlorid ist in der EU durch die Verordnung (EG) Nr. 1334/2008 unter der FL-Nummer 16.027 als Aromastoff zugelassen.
Nahrungsergänzungsmittel
In Deutschland und anderen EU-Ländern ist Thiamin in folgender Form in Nahrungsergänzungsmitteln (NEM) erlaubt:
- Thiaminhydrochlorid
- Thiaminmononitrat
- Thiaminmonophosphatchlorid
- Thiaminpyrophosphatchlorid
Wenn mindestens 0,17 mg Thiamin pro Tagesdosis (etwa 15 % des Referenzwertes) in NEMs erhalten ist, darf mit der Aufrechterhaltung normaler Körperfunktionen geworben werden: Energiestoffwechsel, psychischen Funktion, Funktion des Nervensystems und Herzfunktion. Eine Werbung für eine angebliche zusätzliche Leistungssteigerung ist nicht belegt. Auch für eine postulierte Wirksamkeit bei Nervenschmerzen (neuropathische Schmerzen) fehlen Wirksamkeitsnachweise und dürfen nicht beworben werden.
Vorkommen
Pro 100 g der folgenden Lebensmittel sind laut Bundeslebensmittelschlüssel (BLS) bzw. Römpp Lexikon Chemie die angegebenen Mengen Thiamin enthalten:
| Nahrungsmittel | Thiamin mg/100 g |
|---|---|
| Bierhefe, biologisch | 13,0 |
| Weizenkeime | 2,01 |
| Bienenpollen | 0,6 bis 2,2 |
| Sonnenblumenkerne, frisch | 1,9 |
| Back-/Bierhefe, gepresst | 1,0 |
| Sojabohnen, frisch | 0,44 |
| Sesam, geröstet | 0,4 |
| Vollkorngetreide (Weizen, Gerste, Mais, Reis – nicht erhitzt) | 0,35–0,46 |
| Haferflocken, roh | 0,15 |
| Geflügel, gegart | 0,11 |
| Pellkartoffeln gegart | 0,07 |
Aufnahme und Metabolismus
Thiamin in Lebensmitteln wird zunächst durch Phosphatasen der Verdauungssäfte gespalten, da es nur in freier Form absorbiert wird – überwiegend im Zwölffingerdarm und Jejunum. Die Aufnahme erfolgt entweder durch passive Diffusion bei höherer Thiaminkonzentration im Darmlumen (> 5 μmol/l). Bei geringerer Konzentration wird es dagegen ATP- und natriumionenabhängig aktiv in das Zottenepithel transportiert, was effizienter als die Diffusion ist. Anschließend wird es wieder zu TDP phosphoryliert und gelangt über die Pfortader in die Leber.
Thiamin wird im Blut überwiegend in den Erythrozyten (75 ;%) in Form von TDP transportiert, daneben auch in den Leukozyten sowie im Plasma selbst (dort in Form von TMP oder frei gebunden an Albumin). Nach Aufnahme in Gewebezellen wird Thiamin zu TDP überführt.
Vitamin B1 findet sich in größeren Mengen in Leber, Herz, Niere, Skelettmuskulatur und Gehirn. Es wird bei letzteren mittels aktiven Carrier aufgenommen – und bei einem Mangel dort am längsten festgehalten.
Die biologische Halbwertszeit liegt zwischen 9 und 18 Tagen, im Gewebe werden etwa 1 mg Thiamin pro Tag umgesetzt. Die Speicherfähigkeit im Körper ist begrenzt, es können etwa 25–30 mg Vitamin B1 gespeichert werden. Überschüssiges Vitamin B1 wird abgebaut und über die Niere ausgeschieden – bei höherer Thiaminzufuhr werden im Harn liegen neben dessen reguläre Abbauprodukte zusätzlich freies Thiamin, Thiaminschwefel- und -phosphorsäureester sowie Thiamindisulfid vor.
Bedarf (Zufuhrempfehlung)
| Altersgruppe | D-A-CH (2019)
mg / Tag |
EFSA (2016)
(Population Reference Intake) mg / Tag |
|---|---|---|
| Kleinkinder (4–7 Jahre) | 0,7 | 0,60–0,68 (♂); 0,56–0,64 (♀) |
| Kinder (7–10 Jahre) | 0,9 (♂); 0,8 (♀) | 0,73–0,82 (♂); 0,68–0,76 (♀) |
| Jugendliche (10–13 Jahre) | 1,0 (♂); 0,9 (♀) | 0,82–0,92 (♂); 0,77–0,85 (♀) |
| Jugendliche (13–15 Jahre) | 1,2 (♂); 1,0 (♀) | 0,99–1,06 (♂); 0,89–0,92 (♀) |
| Adoleszente (15–19 Jahre) | 1,4 (♂); 1,1 (♀) | 1,14–1,24 (♂); 0,94–0,96 (♀) (< 18 Jahre) |
| Erwachsene | 1,1–1,3 (♂); 1,0 (♀) | 0,96–1,13 (♂); 0,78–0,91 (♀) (≥ 18 Jahre) |
| Schwangere 1. Trimester 2. Trimester 3. Trimester |
1,2 1,3 |
+ 0,03 + 0,11 + 0,21 |
| Stillende | 1,3 | + 0,21 |
Der Bedarf korreliert mit dem täglichen Energieverbrauch. Daher benötigen Männer und junge Erwachsene etwas mehr Vitamin B1.
Thiamin wird im Blut, in der Leber, der Niere, im Gehirn und in den Muskeln gespeichert, wenngleich die Speicherfähigkeit mit 25–30 mg eher niedrig ist.
Die Einnahme von Vitamin B1 wird immer wieder als Repellent zur Stechmückenbekämpfung vorgeschlagen, Ursprung hat diese These eine Fallberichtsbeschreibung aus Anfang der 1940er Jahre. Zahlreiche spätere methodisch seriöse Untersuchungen haben aber dessen Wirkungslosigkeit wie auch andere oral eingenommene Stoffe oder Supplemente wie Knoblauch demonstriert. Zudem benötigen Stechmücken selbst Vitamin B1.
Versorgungssituation in Deutschland
Laut der Nationalen Verzehrstudie II von Mitte der 2000 Jahre liegt in allen Altersgruppen der Median der Vitamin-B1-Zufuhr deutlich über der empfohlenen Zufuhr, jedoch erreichen 21 % der Männer und 32 % der Frauen die empfohlene tägliche Zufuhr von Vitamin B1 nicht. Daraus resultiert aber nicht notwendigerweise ein Mangel.
Mangelerscheinungen (Hypovitaminose)
Bereits 1896 stellte Christiaan Eijkman nach seiner Rückkehr von seiner Asienreise nach Europa fest: „Weißer Reis kann giftig sein!“ Zuvor hatte er in Java gehäuft Fälle von Beriberi beobachtet, die durch eine gründlichere Politur des weißen Reises verursacht wurde. Mangelerscheinungen treten insbesondere in Ländern auf, in denen weißer Reis das Grundnahrungsmittel darstellt und noch einseitig gegessen wird.
Da ein experimentell erzeugter Vitamin-B1-Mangel sich symptomatisch von den verschiedenen Formen des „natürlich “auftretenden Beriberi unterscheidet, sollte zwischen einer Vitamin-B1- (bzw. Thiaminmangelerkrankung) und Beriberi differenziert werden. Insgesamt gibt es bei Beriberi eine Vielfalt an Symptomen, da diese auch noch von anderen Einflussfaktoren wie z. B. das Alter und andere Hypovitaminosen abhängig sind:
- Störungen des Kohlenhydratstoffwechsels und Nervensystems (u.a. Polyneuropathie)
- Reizbarkeit und Depressionen
- Müdigkeit, Sehstörungen, Appetitlosigkeit, Konzentrationsschwäche, Muskelatrophie
- Blutarmut (Anämie)
- häufige Kopfschmerzen
- Gedächtnisstörungen (Korsakow-Syndrom), Verwirrungszustände
- Herzversagen, Ödeme, Tachykardie, niedriger Blutdruck, Kurzatmigkeit (Dyspnoe)
- Verringerte Produktion von Antikörpern bei Infektionen
- gestörte Energieproduktion
- schwache Muskulatur (besonders die Wadenmuskulatur)
- Krankheiten:
- Mensch: Beriberi, Wernicke-Enzephalopathie, Strachan-Syndrom
- Tiere: Thiaminmangel-Enzephalopathie der Katze, Zerebrokortikalnekrose, Chastek-Paralyse
Ein schwerer, nicht behandelter Vitamin-B1-Mangel ist letal.
Risikogruppen
Insgesamt sind bei normaler, nicht einseitiger Ernährung Mangelerscheinungen sehr selten. In Entwicklungsländern tritt ein erhöhtes Risiko auf, insbesondere bei Menschen in Flüchtlingslagern und Gefängnissen.
In Europa können bestimmte Risikogruppen von einem Mangel betroffen sein, z. B. Alkoholiker, Menschen mit bestimmten Magen-Darm- oder Leberkrankheiten und Frauen mit extremer Schwangerschaftsübelkeit. Bei Alkoholikern manifestiert sich der Mangel am häufigsten als Wernicke-Korsakow-Syndrom; wahrscheinlich werden aber leichte Mangelzustände nicht diagnostiziert.
Alzheimer
Alzheimer-Patienten zeigen eine verminderte Glucose- und Sauerstoffverwertung im Gehirn, die mit einem Thiaminmangel einhergeht. Der Mangel könnte nicht nur die Folge, sondern die Ursache der Krankheit sein. Auch können erniedrigte Thiaminpyrophosphat-Werte in Blut und Gehirn als Diagnosekriterium zur Abgrenzung von Alzheimer zu anderen Formen der Demenz verwendet werden.
Folgen einer Überdosierung (Hypervitaminose)
Thiamin besitzt eine große therapeutische Breite. So zeigen tierexperimentelle Befunde bei Ratten, dass selbst eine 100fach über dem täglichen Bedarf liegende Dosis über drei Generationen ohne Nebenwirkungen vertragen wurde. Nach Verabreichung in den Muskel bzw. in die Vene wurden allerdings in Einzelfällen teils schwerste Überempfindlichkeitsreaktionen bis hin zu Atemnot und Schockzuständen beschrieben. Wegen dieser allergischen Reaktionen sollte Vitamin B1 daher nur in Ausnahmefällen parenteral angewendet werden; orale Therapie der Wahl zur Vitamin-B1-Substitution ist die fettlösliche und dadurch hervorragend gewebegängige Thiamin-Prodrug Benfotiamin. In selten Fällen wurden bei täglicher Aufnahme von mindestens 50 mg Nebenwirkungen wie Augenbeschwerden, Kopfschmerzen, Schweißausbrüche, Hautreaktionen und Herzrhythmusstörungen beobachtet.
Da bei Verzehr auch in hohen Mengen keine nachteiligen gesundheitlichen Folgen beobachtet wurden (oral aufgenommenes Thiamin wird über den Urin ausgeschieden), hat das BfR auf eine Festlegung von Höchstmengen verzichtet.
Geschichte
Als Krankheitsbild geht Beriberi auf einen Thiaminmangel zurück, diese Ursache war im 19. Jahrhundert aber noch nicht bekannt. Eine erste systematische Suche nach seiner Entstehung begann in den späten 1880er Jahren in Niederländisch-Ostindien. Dies hatte militärische Gründe. Die Niederländische Regierung wollte einen Aufstand im Westen ihrer Kolonie niederschlagen, war aber durch zahlreiche Erkrankungsfälle an Beriberi bei den Soldaten vor Ort alarmiert. Vorausgegangen war die Einführung dampfbetriebener Maschinen, die den Reis polierten.
Daher wurde eine Expertenkommission unter Cornelis Pekelharing (* 1848; † 1922), Pathologe der Universität Utrecht, und dessen Assistenten Cornelis Winkler (* 1855; † 1941) berufen, die in Batavia den Grund für die Erkrankung ermitteln sollte. Pekelharing vermutete nach 8 Monaten Untersuchung eine Infektion eines Mikroorganismus. Christiaan Eijkman führte die Arbeiten mit Tierversuchen an Hühnern weiter. Dort traten bei verschiedenen Tiere Erkrankungen auf, die er als Polyneuritiden klassifizierte. Weitere Nachforschungen ergaben, dass der verfütterte Reis einen Einfluss auf das Entstehen der Krankheit hatte – polierter weißer Reis konnte diese verursachen, brauner unpolierter Reis inklusive der Silberhäutchen (Kleie) dagegen verhinderte sie. Auch nach seiner Rückkehr nach Amsterdam 1896/97 rückte Eijkman aber nicht von der Vorstellung ab, dass Beriberi Folge einer „Autointoxikation“ oder chronischen Infektion der Versuchstiere sei, statt eines Mangels. Sowohl Eijkman als auch Pekelharing waren Anhänger der damals neuartigen Keimtheorie, so dass sie Mikroorganismen wie Bakterien als Ursache der Erkrankung vermuteten. Auch die japanische Armee vermutete einen Infektionserreger, wodurch sie Takaki Kanehiros Erkenntnis der 1880er Jahre fehldeutete – Kanehiro konnte zeigen, dass durch zweckmäßige Ernährung (aus dem Vitamin-B-Bereich) Beriberi verhindert werden kann. Wahrscheinlich hatte Eijkman von Takakis Experimenten nichts gehört.
Gerrit Grijns, ein Assistent Eijkmans, führte die Fütterungsversuche fort. Er erkannte, dass der in den Reiskleien enthaltene Faktor hitzelabil ist und dass Beriberi die Folge eines Mangels eines unbekannten Bestandteils der Nahrung sein müsse. So verschwanden die Symptome bei der Fütterung von ungeschältem Reis oder grünen Erbsen und Fleisch. Beide extrahierten einen sog. „anti-polyneuritis factor“ mit Wasser und Ethanol aus Reisschalen. Eijkman selbst war aber noch lange davon überzeugt, damit ein „pharmakologisches Antidot“ gegen die im Reisendosperm (dem weißen Reis) vorhandenen „Beri-Beri-Mikroben“ oder deren „Toxine“ in der Hand zu haben.
Suzuki Umetarō vermochte 1910 aus Reiskleie Thiamin zu isolieren und erkannte dessen Beriberi-heilende Eigenschaften. Er bezeichnete es erst aberic acid und später Oryzanin, seine Arbeit wurde 1911 publiziert. In Japan ignorierte man diese Ergebnisse, da man die Entstehung von Beriberi immer noch einer bakteriellen Infektion zuschrieb. 1912 isolierte Casimir Funk aus Reiskleie Niacin, hielt es aber fälschlicherweise für Thiamin und prägte aufgrund der angeblich entdeckten Aminogruppe den Begriff „Vitamin“ (vitale amine).
Barend Coenraad Petrus Jansen begann mit der Isolierung des Beriberi-verhindernden Vitamins
aus Reiskleie und erkannte, dass es dort in nur geringen Mengen vorhanden ist. 1926 konnten er und sein Kollege
Willem Frederik Donath mit
besseren Aufreinigungsmethoden Thiamin in kristalliner Form aus Reiskleie isoliereren und bezeichneten es als
antineuritisches Vitamin (Aneurin). Eijkman bestätigte, dass selbst geringste Mengen dieses Stoffes
an Beriberi erkrankte Tiere heilen konnte. 1932 erhielt es dann aber von
Adolf Windaus wegen seines Schwefelgehaltes die
Bezeichnung Thiamin, die heute der einzig zulässige Name ist. Weitere Arbeiten führten 1933 dazu, dass die empirische Formel
dieser Kristalle als Hydrochlorid bestimmt
werden konnten: .
Die tatsächliche Strukturaufklärung erwies sich als relativ schwierig, gelang aber 1936 etwa gleichzeitig von
Robert R. Williams und
Rudolf Grewe. Die
Totalsynthese erfolgte schließlich durch
Robert R. Williams und von Hans Andersag und
Kurt Westphal 1937.
1950 entdeckte die japanische Forschergruppe um Motonori Fujiwara das fettlösliche Thiamin-Prodrug Benfotiamin aus gekochtem Knoblauch, mit dem sich hohe Thiaminspiegel in den Zielorganen erreichen lassen.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 17.01. 2026