Pyrimidin
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
Pyrimidin ist ein sechsgliedriges heterocyclisches aromatisches Amin mit zwei Stickstoffatomen, das nach der systematischen Nomenklatur auch als 1,3-Diazin bezeichnet wird. Der Name leitet sich von gr. pyr = Hitze, Feuer (wegen der Verwandtschaft mit Pyridin) und der Stoffklasse der Amidine ab. Pyrimidin ist der Grundkörper der Stoffgruppe der Pyrimidine.
| Strukturformel | |
|---|---|
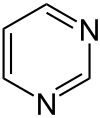 | |
| Allgemeines | |
| Name | Pyrimidin |
| Andere Namen |
|
| Summenformel | C4H4N2 |
| Kurzbeschreibung | farblose bis orangefarbene Verbindung |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 289-95-2 |
| EG-Nummer | 206-026-0 |
| ECHA-InfoCard | 100.005.479 |
| PubChem | 9260 |
| Eigenschaften | |
| Molare Masse | 80,09 g/mol |
| Aggregatzustand | fest bis flüssig |
| Dichte | 1,016 g/cm3 (25 °C) |
| Schmelzpunkt | 20–22 °C |
| Siedepunkt | 123–124 °C |
| Dampfdruck | 19 hPa (22 °C) |
| Löslichkeit | mischbar mit Wasser, Alkohol und Ether |
| Brechungsindex | 1,504 (20 °C) |
| Thermodynamische Eigenschaften | |
| ΔHf0 | 145,9 kJ·mol−1 (flüssig) |
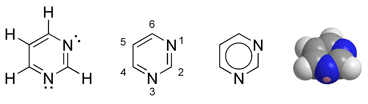
Struktur
Pyrimidin zählt als ein Aza-Analoges (Azalog) des Pyridins zu den heteroaromatischen Diazinen.
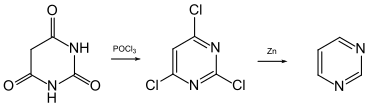
Herstellung
Pyrimidin wurde Ende des 19. Jahrhunderts erstmals von Siegmund Gabriel und James Colman aus Barbitursäure synthetisiert. Diese wurde mit Phosphoroxychlorid umgesetzt, wobei 2,4,6-Trichlorpyrimidin erhalten wurde. Enthalogenierung mit Zinkpulver führte zur Zielverbindung. Enthalogenierungen wurden auch mit 2,4-Dichlorpyrimidin und Tetrachlorpyrimidin durchgeführt.
Über 50 Jahre nach Gabriels Entdeckung wurde im Arbeitskreis um Hellmut Brederec eine Synthese aus C3-Bausteinen und Formamid entwickelt. Als Substitut für den instabilen Malondialdehyd (Propandial) wurden dessen Tetraacetal, 1-Methoxy-1,3,3-triethoxypropan, der Enolether 1,3,3-Triethoxypropen und das Enamin 3-Diethylaminopropenal eingesetzt.

Eigenschaften
Pyrimidin bildet farblose, charakteristisch riechende Kristalle, die schon oberhalb von 20–22 °C schmelzen. Oberhalb des Schmelzpunktes liegt eine farblose Flüssigkeit mit einem Normaldrucksiedepunkt bei 124 °C vor. Die Verdampfungswärme beträgt 49,89 kJ·mol−1. Die Verbrennungsenthalpie wurde mit −2288,9 kJ·mol−1, die Bildungsenthalpie mit 143,2 kJ·mol−1 bestimmt. Die Verbindung ist in Wasser leicht löslich. Mit Säuren bildet sie Salze.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 19.06. 2025