
Alkoholdehydrogenase
| Alkoholdehydrogenase | ||
|---|---|---|
| ||
| ADH1A | ||
| Sekundär- bis Quartärstruktur | Homodimer | |
| Kofaktor | Zn2+ | |
| Isoformen | 7 | |
| Enzymklassifikation | ||
| EC, Kategorie |
| |
| Substrat | Alkohol + NAD+ | |
| Produkte | Carbonylverbindung + NADH + H+ | |
Alkoholdehydrogenasen (ADH) sind Enzyme, die sowohl die Reaktion von Alkoholen zu den entsprechenden Aldehyden oder Ketonen und auch die Rückreaktion dieser (Aldehyd zu Alkohol) katalysieren. Beispiele hierfür sind der letzte Schritt der Alkoholischen Gärung durch Hefe, bei der Acetaldehyd zu Ethanol umgewandelt wird, als auch die umgekehrte Variante (Ethanol zu Acetaldehyd), die im menschlichen Körper im Rahmen des Alkoholabbaus stattfindet. Es handelt sich in jedem Fall um Redoxreaktionen. Alkoholdehydrogenasen kommen in allen Lebewesen vor.
Die katalysierten Reaktionen
Es reagieren ausschließlich primäre und sekundäre Alkohole; tertiäre Alkohole reagieren nicht mit NAD+.
Primärer Alkohol
Ein primärer Alkohol reagiert mit NAD+ zu einem Aldehyd und NADH und umgekehrt (Gleichgewichtsreaktion):
Sekundärer Alkohol
Aus einem sekundären Alkohol und NAD+ entstehen Keton und NADH und umgekehrt (Gleichgewichtsreaktion):
ADH-Isoenzyme im Menschen
Im Humanstoffwechsel koexistieren mindestens fünf unterschiedliche Alkoholdehydrogenasen. Alle sind Dimere aus zwei Polypeptidketten, wobei jede Untereinheit zwei Zinkionen (Zn2+) enthält und zwischen 374 und 386 Aminosäuren lang ist. Eines dieser Ionen ist essenziell für die Funktion des Enzyms: Es ist am aktiven Zentrum lokalisiert und stabilisiert die Hydroxygruppe des Alkohols.
| Klasse | Mögliche Untereinheit | Eigenschaften | ||
|---|---|---|---|---|
| Gen-Name | UniProt | OMIM | ||
| I | Ethanol- und Methanoloxidation | |||
| II | 3,4-Dihydroxyphenylglycol- und 4-Hydroxy-3-methoxyphenylglycol-Biosynthese, sowie
Benzaldehyd-Hydrogenierung (im Abbau von
Adrenalin und
Noradrenalin) Retinol-Metabolismus | |||
| III | Glutathion-abhängige
Formaldehyd-Dehydrogenierung
(EC
| |||
| IV | Ethanoloxidation, Benzylalkohol | |||
| V | Retinoloxidation, Ethanoloxidation (nur hohe Konzentrationen) | |||
Klasse-I ADH
Die Alkoholdehydrogenase 1 (ADH1) katalysiert den Abbau toxischer Alkohole im menschlichen Körper sowie bei vielen Tierarten. Das im Magen und Leber vorhandene Enzym katalysiert hauptsächlich die Oxidation von Ethanol zu Acetaldehyd unter Beteiligung des Cofaktors NAD+:
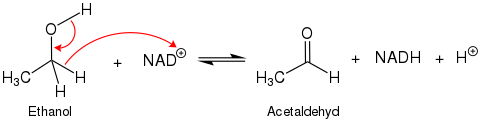
Im menschlichen Körper wirkt ADH1 vor allem in der Leber, allerdings auch im Magen. Auf diese Weise wird beispielsweise in alkoholischen Getränken enthaltenes Ethanol zunächst zu Acetaldehyd und schließlich durch das Enzym Aldehyddehydrogenase 2 (ALDH2) zu Essigsäure oxidiert. Diese wird dann im Citratzyklus zu Wasser und Kohlenstoffdioxid abgebaut. Für das Einschleusen in den Citratzyklus ist das Enzym Acetyl-CoA-Synthetase notwendig, welches unter ATP-Verbrauch Acetyl-CoA bildet.
Die Menge des ADH1-Enzyms im Körper ist von Person zu Person unterschiedlich und bestimmt, wie schnell der getrunkene Alkohol im Körper abgebaut wird. Wie viel Alkohol ein Mensch verträgt (im Sinne von „Trinkfestigkeit“), ist von vielen Faktoren abhängig, z.B. der Gewohnheit, mit einem hohen Alkoholgehalt umzugehen. Im Allgemeinen haben Ostasiaten, indigene Völker Amerikas und Aborigines Australiens eher geringe Mengen ADH im Körper, und Frauen weniger als Männer.
Alkoholdehydrogenase 1 ist verantwortlich für die Toxizität anderer Alkohole: Zum Beispiel oxidiert sie Methanol zu dem wesentlich giftigeren Produkt Methanal (Formaldehyd) sowie Ethylenglycol zu Glycolaldehyd und Glyoxalsäure. Die konventionelle Behandlung dieser Art von Vergiftungen besteht in der Applikation von Ethanol (kompetitive Hemmung von ADH1 durch Ethanol), der bevorzugt in der Leber umgesetzt wird. Solange der Ethanolabbau stattfindet, wird das Methanol durch die Nieren ausgeschieden. Somit tritt keine Vergiftung des Körpers durch das Methanal auf. Außerdem existiert mit Fomepizol (4-Methylpyrazol) die Möglichkeit, ADH1 kompetitiv zu hemmen. Ein weiterer Inhibitor ist 2-Fluorethanol. Außerdem hemmen alle Rheumamittel/Schmerzmittel vom Typ der NSAR die ADH mehr oder minder stark.
Funktionen
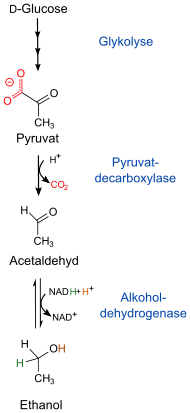
In Hefen und vielen Bakterien spielt die Alkoholdehydrogenase eine wichtige Rolle in der Gärung (vgl. Abbildung):
Pyruvat aus der
Glykolyse wird in Acetaldehyd und Kohlenstoffdioxid umgesetzt,
was eine Pyruvatdecarboxylase
(EC ![]() 4.1.1.1) katalysiert. Anschließend wird der Aldehyd
durch die ADH unter Verbrauch von NADH zu Ethanol reduziert. Auf diese Weise wird für die Glykolyse benötigtes NAD+ regeneriert.
ADH aus Hefe ist größer als die menschliche und besteht aus vier Untereinheiten. Ihr aktives Zentrum besitzt Zink als Metallion.
Dennoch sind die Enzyme aus Pilz und Mensch nahe verwandt.
4.1.1.1) katalysiert. Anschließend wird der Aldehyd
durch die ADH unter Verbrauch von NADH zu Ethanol reduziert. Auf diese Weise wird für die Glykolyse benötigtes NAD+ regeneriert.
ADH aus Hefe ist größer als die menschliche und besteht aus vier Untereinheiten. Ihr aktives Zentrum besitzt Zink als Metallion.
Dennoch sind die Enzyme aus Pilz und Mensch nahe verwandt.
In Insekten wie der Fruchtfliege kommt eine der menschlichen nicht verwandte Alkoholdehydrogenase vor, an die kein Metallion gebunden ist.
Eine dritte Klasse der Alkoholdehydrogenasen enthält Eisen als Zentralion. Diese existieren in Bakterien, und eine (anscheinend inaktive) Form wurde in Hefe gefunden.
Literatur
- Chu-Fang Chou, Ching-Long Lai, Yen-Chun Chang, Gregg Duester, Shih-Jiun Yin: Kinetic mechanism of human class IV alcohol dehydrogenase functioning as retinol dehydrogenase. In: Journal of Biological Chemistry. Band 277, Nr. 28, Juli 2002, S. 25209–25216, doi:10.1074/jbc.M201947200, PMID 11997393.
- Roth, K.: Chemische Köstlichkeiten. 1. Auflage. Weinheim: Wiley-VCH, 2010, ISBN 978-3-527-32752-2.
- Fuchs, G. (Hrsg.): Allgemeine Mikrobiologie. 9. Auflage. Stuttgart: Thieme, 2014, ISBN 978-3-13-444609-8.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 11.10. 2025