
Acetaldehyd
| Sicherheitshinweise | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||
| MAK |
| |||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||
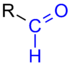
Acetaldehyd [aˈt͡seːt|aldehyːt], auch Acetylaldehyd, nach IUPAC Ethanal genannt, ist ein Aldehyd, genauer ein Alkanal mit zwei Kohlenstoffatomen; somit vom Ethan abgeleitet. Acetaldehyd besitzt die Halbstrukturformel CH3-CHO.
Im menschlichen Körper entsteht Acetaldehyd als Zwischenprodukt beim Abbau von Ethanol durch die Alkoholdehydrogenase. Acetaldehyd ist neben anderen Stoffen für den Kater am nächsten Morgen verantwortlich. Acetaldehyd wird im Regelfall schnell zu Acetat verstoffwechselt. Nach einer Einnahme von Disulfiram oder Coprin (Wirkstoff im Faltentintling) wird die Verstoffwechselung von Acetaldehyd gehemmt und es kommt zu einer Anreicherung im Körper, die mit (meist leichten) Vergiftungssymptomen einhergeht (Antabus- bzw. Coprinus-Syndrom). Bei der Verschwelung bzw. Verbrennung von Tabak entsteht es als Neben-/Pyrolyseprodukt und gelangt so aus dem Tabakrauch über die Lungenbläschen ins Blut. Außerdem wurde Acetaldehyd in pflanzlichen Extrakten, ätherischen Ölen, geröstetem Kaffee> und Mineralwasser (insbesondere bei in Plastik abgepackten Eigenmarken diverser Discounter) nachgewiesen. Manche Laubbäume, wie z.B. Ahorn und Pappeln, geben Acetaldehyd beim Übergang von Licht zu Dunkelheit ab.
Biochemisch gesehen ist Acetaldehyd ebenfalls ein häufiges Zwischenprodukt. So wandeln Hefezellen das in der Glykolyse entstandene Pyruvat in zwei Schritten zu Ethanol um, indem das Pyruvat zuerst mit Hilfe der Pyruvat-Decarboxylase, einem Enzym der Klasse der Lyasen, in Acetaldehyd umgewandelt und anschließend mit Hilfe der Alkoholdehydrogenase, einem Enzym der Klasse der Oxidoreduktasen, in Ethanol umgewandelt wird.
| Strukturformel | |
|---|---|
 | |
| Allgemeines | |
| Name | Acetaldehyd |
| Andere Namen |
|
| Summenformel | C2H4O |
| CAS-Nummer | 75-07-0 |
| PubChem | 177 |
| ECHA-InfoCard | 100.000.761 |
| Kurzbeschreibung | farblose Flüssigkeit oder farbloses Gas mit stechendem Geruch |
| Eigenschaften | |
| Molare Masse | 44,1 g/mol |
| Aggregatzustand | flüssig oder gasförmig |
| Dichte |
|
| Schmelzpunkt | −123 °C |
| Siedepunkt | 20 °C |
| Dampfdruck | 1006 hPa (20 °C) |
| pKs-Wert | 13,57 (25 °C) |
| Löslichkeit | mischbar mit Wasser |
| Dipolmoment | 2,750(6) D (9,2 · 10−30 C · m) |
| Brechungsindex | 1,3316 (20 °C) |
| Thermodynamische Eigenschaften | |
| ΔHf0 |
|
Geschichte
Acetaldehyd wurde wahrscheinlich erstmals im Jahre 1781 von Carl Wilhelm Scheele beim Versuch der Oxidation von Ethanol mit Braunstein in Gegenwart von Schwefelsäure synthetisiert. Die Charakterisierung gelang jedoch erst Justus Liebig in Zusammenarbeit mit Johann Wolfgang Döbereiner im Jahre 1835. Er benannte die Verbindung Aldehyd (von lat. alcoholus dehydrogenatus). Acetaldehyd kann somit als der historisch erste Vertreter der Stoffklasse der Aldehyde angesehen werden, während Formaldehyd (Methanal) der einfachste Vertreter der Klasse ist.
Herstellung
Historisch wurde Acetaldehyd durch Oxidation von Ethanol mit einer Reihe von Oxidationsmitteln, beispielsweise Braunstein/Schwefelsäure (Scheele) oder Chromsäure (Liebig), nach folgender Gleichung erhalten:
Zur großtechnischen Synthese wird im Rahmen des Wacker-Hoechst-Verfahrens Acetaldehyd durch katalytische Wasseraddition an Ethen bei gleichzeitiger Luftoxidation über Festbettkatalysatoren hergestellt. Formal ergibt sich folgende Gleichung:
In den 1970er Jahren stieg die weltweite Produktionskapazität für Acetaldehyd auf über 2 Millionen Tonnen pro Jahr an. Auf Grund der Entwicklung neuer Synthesewege, welche nicht Acetaldehyd als Edukt benötigen, sinkt derzeit jedoch der Bedarf.
Eigenschaften
Acetaldehyd ist eine farblose, sehr leicht flüchtige und leicht entzündliche Flüssigkeit, die mit Wasser in jedem Verhältnis mischbar ist; dabei bildet sich in einer Gleichgewichtsreaktion das Aldehydhydrat. Anders als bei Formaldehyd liegt das Gleichgewicht jedoch nur zu etwas über 50 % auf der Seite des Hydrats.
Acetaldehyd muss kühl gelagert werden, da es schon bei 20 °C siedet und explosive Dampf-Luft-Gemische bildet. Diese Dämpfe können sich aufgrund des extrem niedrigen Zündpunkts von 140 °C an heißen Heizflächen entzünden. Der Flammpunkt von Acetaldehyd liegt bei −39 °C und seine UN-Nummer ist 1089.
Acetaldehyd oligomerisiert leicht säurekatalysiert zu Aldoladditionsprodukten.
- Das „Dimer“ (CH3CHO)2 ist das sogenannte Aldol.
- Das Trimer (CH3CHO)3 hat eine cyclische Acetalstruktur (2,4,6-Trimethyl-1,3,5-trioxan). Es handelt sich um eine Flüssigkeit (Sdp. 124 °C) mit dem Trivialnamen Paraldehyd.
- Das Tetramer (CH3CHO)4 hat ebenfalls cyclische Acetalstruktur (2,4,6,8-Tetramethyl-1,3,5,7-tetroxocan). Es handelt sich um einen Feststoff (sublimiert bei 112 °C), auch Metaldehyd genannt. Es wird als Trockenbrennstoff und wegen seiner Giftigkeit auch als Schneckengift (Schneckenkorn) verwendet.
- Zumeist enthält Trockenbrennstoff auch höhere Oligomere des Acetaldehyds, wie z.B. Pentamere (CH3CHO)5 und Hexamere (CH3CHO)6.
Die Oligomere mit Acetalstruktur können leicht wieder durch Säuren gespalten werden.
Tautomerie
Acetaldehyd besitzt ein instabiles Tautomer, den Vinylalkohol oder Ethenol. Dieses einfachste Enol isomerisiert in freiem Zustand unter Normalbedingungen sofort zu Acetaldehyd, sofern es nicht – etwa als Eisencarbonyl- oder Platin-Komplex Pt(acac)(η2-C2H3OH)Cl – stabilisiert wird.
-
 Tautomeres Gleichgewicht zwischen Ethanal (Acetaldehyd, links) und Ethenol (Vinylalkohol, rechts)
Tautomeres Gleichgewicht zwischen Ethanal (Acetaldehyd, links) und Ethenol (Vinylalkohol, rechts)
Wirkungen in der Leber und am Herzen
Die schädlichen Wirkungen des Acetaldehyds in Leber und Herz sind vielfältig. Es bildet Proteinaddukte, die die sogenannte Kupffer-Zellen (Makrophagen der Leber) aktivieren. Diese sezernieren verstärkt Stoffe, die andere Zellen der Leber, die Itozellen, so verändern, dass diese daraufhin verstärkt Kollagen bilden. Das begünstigt die Ausbildung einer Leberzirrhose. Außerdem führt Acetaldehyd über die Aktivierung der NADPH-Oxidase (NOX2) zur vermehrten Bildung von Sauerstoffradikalen, welche die Membranen der Zellen schädigen, so dass diese zugrunde gehen. Davon betroffen sind auch die Mitochondrien der Kardiomyozyten, was zunächst die Fähigkeit der Herzmuskelzellen zur Kontraktion beeinträchtigt und diese im weiteren Verlauf zerstört, so dass es zu einer irreparablen Schädigung des Muskels und schließlich zur chronischen Herzinsuffizienz kommt.
Verwendung
Acetaldehyd ist ein wichtiger Ausgangsstoff in der chemischen Industrie. Acetaldehyd dient beispielsweise zur Herstellung von Essigsäure, Essigsäureanhydrid, Butadien, Acrolein und Pentaerythrit.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 20.11. 2024




