
Kompetitive Hemmung
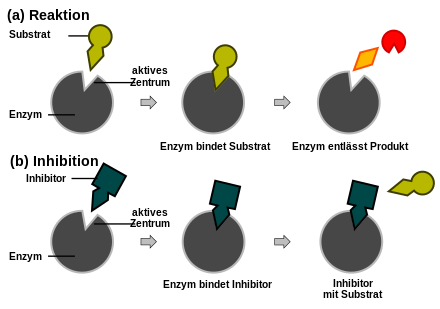
Als kompetitive Hemmung (lat. competere, zusammen etwas begehren) wird in der Biochemie und Pharmakologie eine Enzymhemmung bezeichnet, bei der ein Agonist und ein Antagonist um die Besetzung eines Rezeptors konkurrieren, wobei der Antagonist keine biochemische Wirkung hat. Die entsprechenden antagonistischen Substanzen bezeichnet man als kompetitive Antagonisten.
Wirkungsweise
Agonisten sind Substanzen, die Rezeptoren besetzen und mit ihnen Komplexe bilden, welche eine bestimmte Wirkung im Körper erzielen. Ein Rezeptor ist eine reizaufnehmende Stelle im Körper, welche der Struktur ihrer spezifischen Substanzen nach dem Schlüssel-Schloss-Prinzip angepasst ist. Die Fähigkeit einer Substanz, im Körper durch diesen Mechanismus eine Wirkung zu erzielen, nennt sich Intrinsische Aktivität. Antagonisten haben sehr ähnliche chemische Strukturen wie die jeweiligen Agonisten und können deren spezifische Rezeptoren besetzen. Allerdings erzielt der Antagonist-Rezeptor-Komplex keine Wirkung, wodurch die Wirkung des Rezeptors unterbunden wird.
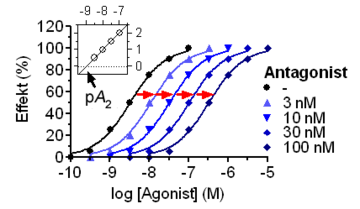
Die Stärke des Bindungsbestrebens zwischen einer Substanz und dem Rezeptor bezeichnet man als Affinität. Um die Agonisten von ihren Rezeptoren zu verdrängen und damit den hemmenden Effekt auszuüben, müssen Antagonisten entsprechend dem Massenwirkungsgesetz eine größere Affinität besitzen oder in höherer Konzentration vorliegen. Im Gegensatz zu nichtkompetitiven Antagonisten können kompetitive Antagonisten auch durch Agonisten in höherer Konzentration verdrängt werden. Die Wirkstärke eines kompetitiven Antagonisten (pA2-Wert) kann mit Hilfe des Schild-Plots ermittelt werden.
In der Pharmazie handelt es sich bei Agonisten oftmals um physiologische, d.h. körpereigene Substanzen wie Enzyme und Mediatoren und deren Antagonisten in Form von Arzneimitteln. Zum Beispiel ist Histamin als entzündungsvermittelndes Gewebshormon ein physiologischer Agonist, welches seinen spezifischen Histamin-Rezeptor besetzt und im Gewebe typische Entzündungsmerkmale wie z.B. Rötung, Schwellung und Schmerz auslöst. H1-Antihistaminika sind chemisch dem Histamin sehr ähnlich und verdrängen es von seinem Rezeptor. Sie haben keine Eigenwirkung und verringern bzw. verhindern somit die Entzündungsweiterleitung.
Jedoch spielen auch synthetisch, oder in selteneren Fällen biotechnologisch, erzeugte Agonisten eine Rolle als Pharmazeutika und/oder psychotrope Substanzen. So binden bspw. die als Analgetika, Antitussiva, Antidiarrhoika oder Rauschdrogen verwendeten Opioide als Agonisten an einen oder mehrere der Opioiderezeptor-Subtypen, Adrenorezeptoragonisten wie Clonidin werden zur Behandlung der arteriellen Hypertonie (Bluthochdruck), unterstützend während Narkosen und bei der Dämpfung von Entzugserscheinungen eingesetzt, 5-HT2A Agonisten wie LSD, Dimethyltryptamin oder Meskalin sind als klassische Halluzinogene bekannt. Insbesondere bei als Rauschdrogen verwendeten Substanzen spielen kompetitive Antagonisten wie der Opioid-Antagonist Naloxon eine wichtige Rolle in der notfallmedizinischen Behandlung von Überdosierungen.
Der Einbau von p-Aminobenzoesäure durch pathogene Bakterien in lebenswichtige Substanzen kann durch chemisch ähnliche Sulfonamide verhindert werden, die als kompetitiver Inhibitor der Tetrahydrofolat-Reduktase wirken.
Literatur
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 6 Auflage, Spektrum Akademischer Verlag, Heidelberg 2007. ISBN 978-3-8274-1800-5.
- Donald Voet, Judith G. Voet: Biochemistry. 3. Auflage, John Wiley & Sons, New York 2004. ISBN 0-471-19350-X.
- Bruce Alberts, Alexander Johnson, Peter Walter, Julian Lewis, Martin Raff, Keith Roberts: Molecular Biology of the Cell, 5. Auflage, Taylor & Francis 2007, ISBN 978-0815341062.
- Maximilian von Heyden, Dr. sc. hum. Henrik Jungaberle, Dr. med. Tomislav Majić: Handbuch Psychoaktive Substanzen 1. Auflage, Springer Verlag, Heidelberg 2018. ISBN 978-3642551246.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 04.01. 2026