Perchlorsäure
| Sicherheitshinweise | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||
Perchlorsäure, HClO4, ist eine Sauerstoffsäure des Chlors. Ihre Salze heißen Perchlorate.
| Strukturformel | |
|---|---|
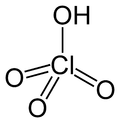 | |
| Allgemeines | |
| Name | Perchlorsäure |
| Andere Namen |
|
| Summenformel | HClO4 |
| Kurzbeschreibung | farblose, ölige, hygroskopische, an der Luft rauchende Flüssigkeit |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 7601-90-3 |
| EG-Nummer | 231-512-4 |
| ECHA-InfoCard | 100.028.648 |
| PubChem | 24247 |
| ChemSpider | 22669 |
| Eigenschaften | |
| Molare Masse | 100,46 g/mol |
| Aggregatzustand | flüssig |
| Dichte | 1,77 g/cm3 |
| Schmelzpunkt | −112 °C |
| Siedepunkt | 130 °C |
| Dampfdruck | 40 hPa (20 °C) |
| pKS-Wert | −10 |
| Löslichkeit | mischbar mit Wasser, Essigsäure, Chloroform, Nitromethan, Benzol, Dichlormethan, Dichlorethen und Acetonitril |
Eigenschaften
Wasserfreie Perchlorsäure wirkt stark oxidierend, raucht an der Luft und ist hygroskopisch und flüchtig. Perchlorsäure ist eine sogenannte Supersäure, also eine extrem starke Säure (pKS = −10). Sie verursacht schwere Verätzungen und ist hochreaktiv. Beim Erwärmen, vor allem von Perchlorsäure mit über 50 Prozent Massenanteil, besteht Explosionsgefahr, ebenso beim Einengen oder Konzentrieren mit Trocknungsmitteln. Wasserfreie Perchlorsäure kann sich bereits bei Raumtemperatur spontan zersetzen. Zusammen mit einer Vielzahl anderer Stoffe kann es zu stark exothermen Reaktionen, Hitzeentwicklung, Entzündung, Explosion oder Bildung explosiver Gase und Dämpfe kommen. Bei Berührung mit brennbaren Stoffen besteht Brandgefahr, da die Säure wegen ihres hohen Sauerstoffanteils brandfördernd ist.
Anhydrid
Das Anhydrid der Perchlorsäure ist Dichlorheptoxid (Cl2O7). Es kann durch vorsichtige Umsetzung von Perchlorsäure mit Phosphorpentoxid mit einer sich anschließenden Vakuum-Destillation dargestellt werden. Dichlorheptoxid ist hochexplosiv und reagiert mit Wasser wieder zu Perchlorsäure.
Herstellung
Perchlorsäure wird durch Zugabe von starken Säuren, z.B. Schwefelsäure, aus
ihren Salzen, z.B. Kaliumperchlorat
freigesetzt. Kaliumperchlorat lässt sich durch Disproportionierung
aus elektrolytisch hergestelltem Kaliumchlorat
KClO3 beim Erhitzen erzeugen.
Perchlorsäure entsteht ebenfalls aus der Reaktion von Natriumperchlorat und
konzentrierter Salzsäure:
Verwendung
Perchlorate sind starke Pflanzengifte und daher in Unkrautbekämpfungsmitteln neben Chloraten enthalten. Als Oxidationsmittel werden Perchlorate auch in manchen Sprengstoffen und Raketentreibstoffen verwendet.
In der Analytik von Schwermetallen wurde früher wegen ihrer stark oxidierenden Wirkung eine konzentrierte (> 60%ige) Perchlorsäure zum Aufschluss fester anorganischer Proben eingesetzt. Dies geschah im Allgemeinen bei hohen Temperaturen. Es besteht die Gefahr, dass sich die Säure dabei unter Abdampfen von Wasser weiter aufkonzentriert. Wegen der Explosionsgefährlichkeit der Perchlorsäure und ihrer Dämpfe wird diese Methode heute nicht mehr empfohlen. Mit organischem Material sollte konzentrierte Perchlorsäure dabei keinesfalls in Berührung kommen.
In der Analytischen Chemie wird Perchlorsäure insbesondere für wasserfreie Titrationen (Aminzahl) eingesetzt. Dazu wird Perchlorsäure in Eisessig (konzentrierte Essigsäure) gelöst. Dabei entstehen Acidiumionen:
In der Biochemie wird Perchlorsäure zur Fällung von Proteinen eingesetzt. In der klinischen Chemie macht man sich diesen Effekt zur sofortigen Deaktivierung von Enzymen bei der Untersuchung spezieller Stoffwechsel-Parameter (z.B. Pyruvat) zunutze.
Sicherheitshinweise
Perchlorsäure wirkt stark ätzend auf Haut, Atemwege und Schleimhäute. Sie ist in der Lage, lebendes Gewebe zu zerstören. Als starkes Oxidationsmittel wirkt sie brandfördernd. Zusammen mit einer Vielzahl anderer Stoffe kann es zu stark exothermen Reaktionen, Hitzeentwicklung, Entzündung, Explosion oder Bildung explosiver Gase und Dämpfe kommen. Verdünnte Perchlorsäurelösungen sind weniger gefährlich und stabiler.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 12.03. 2023



