
Nitromethan
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| MAK | Schweiz: 100 ml/m3 bzw. 250 mg/m3 | ||||||||
| Toxikologische Daten | 940 mg/kg (LD50, Ratte, oral) | ||||||||
Nitromethan, CH3NO2, ist die einfachste organische Nitroverbindung. Die Verbindung ist der einfachsubstituierte Vertreter der Reihe der Nitromethane mit Nitromethan, Dinitromethan, Trinitromethan und Tetranitromethan. Es ist ein Nitroalkan und ein Konstitutionsisomer der Carbamidsäure.
Darstellung und Gewinnung
Im Labor liefert die Reaktion von Natriumchloracetat mit Natriumnitrit oder von Brommethan mit Silbernitrit Nitromethan. Die technische Gewinnung erfolgt durch die Nitrierung von Methan bzw. durch eine Gasphasennitrierung von Propan, wo es mit etwa 25 % im resultierenden Nitroalkangemisch enthalten ist.
Eigenschaften
Nitromethan ist eine farblose, schwach riechende, leicht entzündliche Flüssigkeit mit einem Schmelzpunkt von −29 °C und Normaldrucksiedepunkt von 100,8 °C. Nitromethan ist in Wasser nur begrenzt mischbar. Mit steigender Temperatur steigt die Löslichkeit von Nitromethan in Wasser bzw. steigt die Löslichkeit von Wasser in Nitromethan.
-
Löslichkeiten zwischen Nitromethan und Wasser Temperatur °C 0 9,5 19,7 31,0 40,4 50,0 60,5 70,5 80,2 89,8 Nitromethan in Wasser in Ma-% 9,0 9,7 10,4 11,7 12,8 14,8 15,1 17,1 19,6 20,8 Wasser in Nitromethan in Ma-% 1,10 1,44 1,91 2,50 3,65 5,8 6,13 7,92 8,18 10,42
Das 1H-NMR-Spektrum zeigt nur ein einziges Signal bei 4,28 ppm für die C-H-Funktion. Dies ist eine signifikante Verschiebung gegenüber dem Methan mit 0,23 ppm. Für die Verbindung können zwei tautomere Strukturen formuliert werden. Neben dem Nitrotautomer existiert noch ein Nitronsäuretautomer. Das Gleichgewicht liegt allerdings praktisch auf der Seite des Nitrotautomers. Quantenchemische Berechnungen ergeben eine Differenz der freien Enthalpie von 59,8 kJ/mol zur Nitronsäurestruktur. Die Salzbildung in Gegenwart von Alkalilaugen, wie Natronlauge führt zu den entsprechenden Nitronsäuresalzen.

Die Dämpfe wirken auf das Zentralnervensystem, längere Exposition oder Verschlucken führen zu Leber- und Nierenschäden.
Thermodynamische Eigenschaften
Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,11350, B = 1229,574 und C = −76,221 im Temperaturbereich von 404,9 bis 476 K bzw. mit A = 4,40542, B = 1446,196 und C = −45,633 im Temperaturbereich von 328,86 bis 409,5 K.
-
Zusammenstellung der wichtigsten thermodynamischen Eigenschaften Eigenschaft Typ Wert [Einheit] Bemerkungen Standardbildungsenthalpie ΔfH0liquid
ΔfH0gas−113 kJ/mol
−81 kJ/molals Flüssigkeit
als GasVerbrennungsenthalpie ΔcH0liquid −709,6 kJ/mol als Flüssigkeit Wärmekapazität cp 105,98 J·mol−1·K−1 (25 °C) als Flüssigkeit Kritische Temperatur Tc 588 K Kritischer Druck pc 63,1 bar Kritische Dichte ρc 5,77 mol/l Schmelzenthalpie ΔfH0 9,703 kJ/mol beim Schmelzpunkt Verdampfungsenthalpie ΔVH0 33,99 kJ/mol beim Normaldrucksiedepunkt
| Strukturformel | ||
|---|---|---|
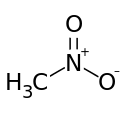 | ||
| Allgemeines | ||
| Name | Nitromethan | |
| Andere Namen | Nitrocarbol | |
| Summenformel | CH3NO2 | |
| CAS-Nummer | ||
| EG-Nummer | 200-876-6 | |
| ECHA-InfoCard | ||
| PubChem | ||
| UN-Nummer | 1261 | |
| Gefahrnummer | 3 | |
| Kurzbeschreibung |
farblose Flüssigkeit mit fruchtigem Geruch Ottokraftstoff für Renn- und Hochleistungsmotoren | |
| Eigenschaften | ||
| Molare Masse | 61,04 g/mol | |
| Aggregatzustand | flüssig | |
| Dichte | 1,14 g/cm3 | |
| Schmelzpunkt | −29 °C | |
| Siedepunkt | 100,8 °C | |
| Dampfdruck | 36,4 hPa (20 °C) | |
| pKs-Wert | 10,2 | |
| Löslichkeit |
| |
| Dipolmoment | 3,1 D | |
| Brechungsindex | 1,38056 | |
| Eigenschaften | ||
| Aggregatzustand | flüssig | |
| Heizwert | 11,3 MJ/kg | |
| Flammpunkt | 36 °C | |
| Zündtemperatur | 415 °C | |
| Explosionsgrenze | 7,1–63 Vol.-% | |
| Temperaturklasse | T2 | |
| Explosionsklasse | IIA | |
Die Temperaturabhängigkeit der Verdampfungsenthalpie lässt sich entsprechend der Gleichung ΔVH0=Aexp(−βTr)(1−Tr)β (ΔVH0 in kJ/mol, Tr =(T/Tc) reduzierte Temperatur) mit A = 53,33 kJ/mol, β = 0,2732 und Tc = 588 K im Temperaturbereich zwischen 318 K und 374 K beschreiben.
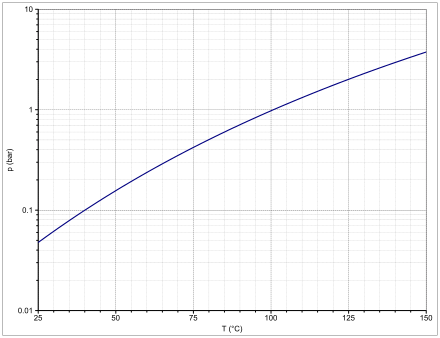
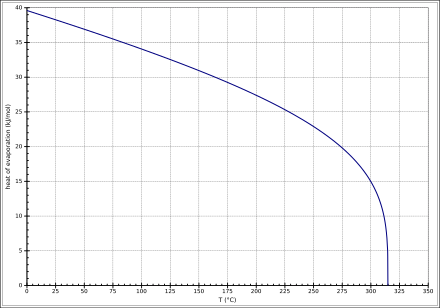
Sicherheitstechnische Kenngrößen
Nitromethan bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von 36 °C. Der Explosionsbereich liegt zwischen 7,3 Vol.‑% (180 g/m3) als untere Explosionsgrenze (UEG) und 63 Vol.‑% (1600 g/m3) als obere Explosionsgrenze (OEG). Eine Korrelation der Explosionsgrenzen mit der Dampfdruckfunktion ergibt einen unteren Explosionspunkt von 33 °C sowie einen oberen Explosionspunkt von 86 °C. Die Grenzspaltweite wurde mit 1,11 mm bestimmt. Es resultiert damit eine Zuordnung in die Explosionsgruppe IIA. Die Zündtemperatur beträgt 415 °C. Der Stoff fällt somit in die Temperaturklasse T2.
Bei der Handhabung sind Sicherheitsregeln zu beachten, da Nitromethan detonationsfähig ist. Zwar ist die mechanische Empfindlichkeit sehr gering, im unreinen Zustand oder als Mischung mit anderen Stoffen, zum Beispiel Aminen, kann jedoch die Empfindlichkeit erhöht sein. Wichtige Explosionskennzahlen sind:
- Explosionswärme: 1026 kJ·kg−1 (H2O (g)).
- Detonationsgeschwindigkeit: 6210 m·s−1 bei der Dichte von 1,14 g/cm3
- Normalgasvolumen: 1102 l/kg.
- Spezifische Energie: 1245 kJ/kg.
- Bleiblockausbauchung: 430 ml/10 g.
Gemische von Nitromethan mit Methanol sind ebenfalls detonationsfähig. Die Detonationsgeschwindigkeit sinkt mit zunehmenden Methanolanteil linear ab und sinkt bei einem Anteil von 35 % Methanol auf 5.08 km/s.
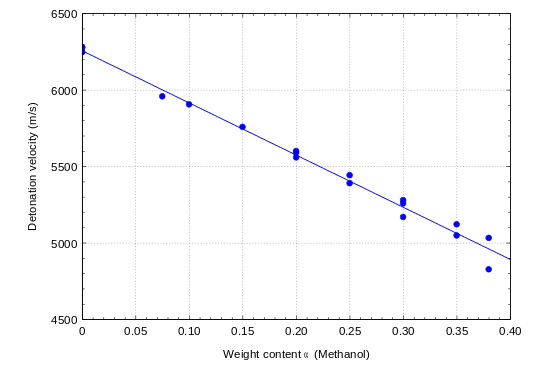
Verwendung
Nitromethan wird als Lösungsmittel für die Spektroskopie und Hochleistungsflüssigkeitschromatographie, zur Herstellung von Raketentreibstoffen, Explosivstoffen (PLX, ANNM), Insektiziden und als Zusatz für Ottokraftstoffe verwendet.
In der organischen Chemie ist es ein nützliches Reagenz, da es sich leicht deprotonieren lässt und in dieser Form Reaktionen wie etwa die Nitro-Aldolreaktion, auch Henry-Reaktion genannt, eingeht, durch die sich leicht aliphatische Nitroverbindungen herstellen lassen.
Die Verwendung als Rennkraftstoff ist sowohl historisch als auch aktuell die wichtigste Verwendung.
Historische Verwendung
Erste belegte Anwendung als leistungssteigerndes Kraftstoffadditiv für Verbrennungsmotoren findet Nitromethan 1950, als Rodger Ward, ein US-amerikanischer Rennfahrer, eine Reihe überraschender Rennsiege erringt. Vic Edelbrock, zuständig für das Motorentuning, hatte in Versuchsreihen mit unterschiedlichen Nitromethananteilen im Benzin eine erhebliche Leistungssteigerung erzielt. Allerdings benötigten die Motoren noch langwierige Anpassungen, um mit diesem Kraftstoff Renndistanz zu überstehen.
Heutige Verwendung
Beim Modellbau werden für RC-Cars und Flugmodelle meist Glühzündermotoren mit Methanol/Nitromethan-Gemisch eingesetzt. Nitromethan verbessert die Leistung der Modellbaumotoren, wirkt sich aber gleichzeitig auch kühlend aus, wobei die Kühlung des Motors schwächer ist als die Erhitzung durch die Leistungssteigerung.
Im Motorsport wird ein Gemisch aus Methanol mit bis zu 85 % Nitromethan
für die Top-Fuel-Dragster-Fahrzeugklasse
als Treibstoff verwendet. Es kommen dabei PKW-Ottomotoren
zum Einsatz, wobei der Aufwand für die Modifikation vergleichsweise gering ist.
Weitergehende Umstellungen der Kennlinie, wie etwa bei reiner Methanol-Feuerung,
sind hier nicht erforderlich.
Mit reinem Nitromethan ist etwa die doppelte
Leistung eines mit Benzin betriebenen Motors möglich, mit entsprechend höherer
thermischer und mechanischer Belastung.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 15.10. 2024


