Disproportionierung
Bei einer als Disproportionierung (oder auch als Dismutation) bezeichneten chemischen Reaktion reagiert im Verlauf einer intramolekularen Redoxreaktion ein mehrfach vorhandener Bestandteil einer Verbindung – z.B. eine Atomsorte – sowohl als Oxidationsmittel wie auch als Reduktionsmittel. Nach Ablauf der Disproportionierungsreaktion liegt dieser Bestandteil (Atomsorte), der vorher in einer mittleren Oxidationsstufe vorlag, sowohl in einer erhöhten als auch in einer im gleichen Ausmaß erniedrigten Oxidationsstufe vor. Die betreffende Atomsorte wird also teils oxidiert und im gleichen Ausmaß reduziert. Die umgekehrt verlaufende Reaktion nennt man Komproportionierung oder Synproportionierung.
Beispiele
- Einfache Beispiele für Disproportionierungen: Reaktion von elementarem Chlor in Natronlauge. Im Verlauf der Reaktion wird ein Chlor-Atom des Chlormoleküls (Oxidationszahl 0) zum Chlorid-Anion reduziert (Oxidationszahl −I), das andere Chlor-Atom wird zum Hypochlorit-Anion (Oxidationszahl + I) oxidiert.
- Chlor reagiert in kalter Natronlauge (exotherm) zu Natriumchlorid, Natriumhypochlorit und Wasser.
- In warmer Natronlauge kann das gebildete Natriumhypochlorit mit überschüssigem Chlor weiter zu Natriumchlorat oxidiert werden.
- Diese Reaktion wird auch bei der Wasseraufbereitung im Schwimmbad genutzt. Bei der Einleitung von Chlor in Wasser liegt dann in Abhängigkeit vom pH-Wert ein Gleichgewicht aus Chlor, Hypochloriger Säure und Salzsäure vor.
- Je nach pH-Wert dissoziiert die Hypochlorige Säure teilweise zu Oxonium- und Hypochlorit-Ionen:
- Reaktion bei der Auflösung von Stickstoffdioxid in Wasser:
- In zwei Molekülen Stickstoffdioxid
werden die N-Atome (Oxidationszahl IV) zu
oxidiert (N-Oxidationszahl +V). Im dritten Molekül
wird das N-Atom zum Stickstoffmonoxid
(N-Oxidationszahl + II) reduziert.
- Komplizierteres Beispiel für eine Disproportionierungsreaktion: Disproportionierung von Kaliumchlorat (Chlor-Oxidationszustand V) unter Bildung von Kaliumchlorid (Chlor-Oxidationszustand -I) und Kaliumperchlorat (Chlor-Oxidationszustand VII). Diese Reaktion muss gemäß folgender Reaktionsgleichung verlaufen, denn nur dann ist die Bilanz hinsichtlich der Erhöhung bzw. der Erniedrigung der Oxidationszahlen der Chloratome ausgeglichen: 3 Chlor-Atome erfahren eine Erhöhung ihrer Oxidationszahl um jeweils 2 Stufen und dementsprechend erfährt 1 Chlor-Atom eine Erniedrigung seiner Oxidationszahl um 6 Stufen.
- Kaliumchlorat reagiert exotherm zu Kaliumchlorid und Kaliumperchlorat.
Radikalische Disproportionierung
- Ein Spezialfall ist die radikalische Disproportionierung in der organischen Chemie: Bei dieser Reaktion wird der Oxidationszustand des zentralen C-Atoms im Radikal links im gleichen Maße erhöht, wie sich der Oxidationszustand des zentralen C-Atoms im Radikal rechts erniedrigt. Formal gesehen wird ein H-Atom vom linken auf das rechte Radikal übertragen.

Cannizzaro-Reaktion
Bei der Cannizzaro-Reaktion disproportionieren Aldehyde, die kein Wasserstoffatom in α-Stellung zum aldehydischen Kohlenstoffatom besitzen, in Gegenwart von starken Basen wie konzentrierter Natronlauge. Als Oxidationsprodukt entsteht das entsprechende Salz einer Carbonsäure (z.B. Natriumsalz), als Reduktionsprodukt der Alkohol:
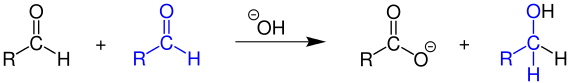
Ist jedoch ein α-ständiges Wasserstoffatom im Aldehyd vorhanden, wird die Aldolreaktion bevorzugt.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 07.03. 2025