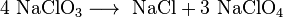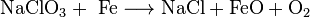Natriumchlorat
| Sicherheitshinweise | |||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||
| Toxikologische Daten | 1200 mg/kg (LD50, Ratte, oral) | ||||||||||||||||||||||
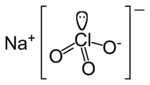
Natriumchlorat (veraltet auch chlorsaures Natrium) NaClO3 ist das Natriumsalz der Chlorsäure (HClO3).
| Strukturformel | |
|---|---|
 | |
| Allgemeines | |
| Name | Natriumchlorat |
| Andere Namen | chlorsaures Natrium |
| Summenformel | NaClO3 |
| CAS-Nummer | 7775-09-9 |
| Kurzbeschreibung | farbloser, kristalliner, wasserlöslicher, hygroskopischer Feststoff |
| Eigenschaften | |
| Molare Masse | 106,4410 g/mol |
| Aggregatzustand | fest |
| Dichte | 2,49 g/cm3 (15 °C) |
| Schmelzpunkt | 248 °C |
| Siedepunkt | Zersetzung ab 300 °C |
| Löslichkeit | gut in Wasser (916 g/l bei 20 °C) |
| Brechungsindex | 1,5151 |
Darstellung und Gewinnung
Natriumchlorat wird durch Elektrolyse von Natriumchloridlösung hergestellt. Das an der Anode gebildete Chlor (Cl2) reagiert zu Hypochlorit, das seinerseits durch anodische Oxidation in Chlorat übergeht.
Es kann auch durch Einleiten von Chlorgas in eine warme NaOH-Lösung hergestellt werden. Mit anschließender Kristallisation erhält man das Natriumchlorat.
Eigenschaften
Natriumchlorat bildet farblose, wasserlösliche, kubische Kristalle. Es disproportioniert bei erhöhter Temperatur zunächst in Natriumperchlorat und Natriumchlorid, wobei Natriumperchlorat bei stärkerem Erhitzen weiter in Natriumchlorid und Sauerstoff zerfällt.
Wässrige Lösungen reagieren schwach sauer.
Verwendung
Natriumchlorat wird größtenteils als Bleichmittel in der Papierindustrie verwendet und ist auch für die Textilindustrie geeignet. Die Elementar-Chlor-Freie-Bleiche (ECF-Bleiche) bei der Zellstoffherstellung führte in den 1990er Jahren zu einer stark wachsenden Erzeugung von Natriumchlorat. Bereits um 1985 wurden fast 80 % der hergestellten Mengen zur Freisetzung von Chlordioxid verwendet. Zurzeit werden etwa 90 % der Weltproduktion zu Chlordioxid weiterverarbeitet. Weiterhin dient Natriumchlorat zur Herstellung von Natriumchlorit, Perchloraten sowie als Unkrautvernichtungsmittel. Chlorate sind jedoch innerhalb der EU als Wirkstoffe in Pflanzenschutzmitteln nicht mehr zugelassen; ein bekannter Handelsname der chlorathaltigen Herbizide war „UnkrautEx“. Früher diente es als Oxidans in einigen Explosivstoffen, doch diese werden wegen ihrer Handhabungsunsicherheit schon lange nicht mehr hergestellt.
Natriumchlorat ist in chemischen Sauerstoffgeneratoren (Sauerstoffkerzen) enthalten, wie sie sich in Passagierflugzeugen über jedem Sitz befinden; sie sind per Schlauch mit einer Sauerstoffmaske verbunden. Bei Druckverlust fallen diese Masken aus einer kleinen Kammer über dem Sitz. Der Sauerstoffgenerator wird durch das Heranziehen der Maske aktiviert. Dabei reagiert das Natriumchlorat mit Eisen zu Natriumchlorid, Eisen(II)-oxid und Sauerstoff.
Durch die bei dieser Reaktion freigesetzte Wärme wird der Generator bis zu 260 Grad Celsius heiß.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 07.03. 2025