Dimethylsulfoxid
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| MAK | Schweiz: 50 ml/m3 bzw. 160 mg/m3 | ||||||
| Toxikologische Daten | 14500 mg/kg (LD50, Ratte, oral) | ||||||
Dimethylsulfoxid (Abkürzung DMSO) ist ein organisches Lösungsmittel und zählt zur Verbindungsklasse der Sulfoxide.
Darstellung und Gewinnung
Technisch wird Dimethylsulfoxid aus Dimethylsulfid z.B. durch katalytische Oxidation mit Distickstofftetroxid in Anwesenheit von Sauerstoff hergestellt. Im Labor kann der Thioether Dimethylsulfid mit stöchiometrischen Mengen Wasserstoffperoxid oder verdünnter Salpetersäure oxidiert werden. Das Dimethylsulfoxid kann allerdings weiter zu Dimethylsulfon oxidiert werden:
| Strukturformel | |
|---|---|
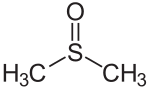 | |
| Allgemeines | |
| Name | Dimethylsulfoxid |
| Andere Namen |
|
| Summenformel | C2H6OS |
| Kurzbeschreibung | farb- und geruchlose Flüssigkeit |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer | 67-68-5 |
| EG-Nummer | 200-664-3 |
| ECHA-InfoCard | 100.000.604 |
| PubChem | 679 |
| ChemSpider | 659 |
| DrugBank | DB01093 |
| Eigenschaften | |
| Molare Masse | 78,13 g/mol |
| Aggregatzustand | flüssig |
| Dichte | 1,10 g/cm3 (20 °C) |
| Schmelzpunkt | 18 °C |
| Siedepunkt | 189 °C |
| Dampfdruck |
|
| Löslichkeit | mischbar mit Wasser, Alkoholen, Aceton, Chloroform und Benzol, nicht aber mit Alkanen |
| Dipolmoment | 3,96(4) D (1,3 · 10−29 C · m) |
| Brechungsindex | 1,4793 (20 °C) |
| Thermodynamische Eigenschaften | |
| ΔHf0 | −204,2 kJ/mol |
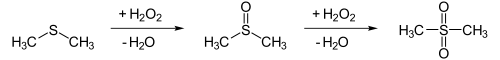
DMSO fällt daneben als Nebenprodukt bei der Zellstoffherstellung an.
Eigenschaften
Physikalische Eigenschaften
Dimethylsulfoxid ist eine farb- und geruchlose, hygroskopische Flüssigkeit. Nach längerer Lagerung weist es häufig einen fauligen Geruch (nach Dimethylsulfid) auf. Mit einem Schmelzpunkt bei 18 °C kann die Substanz nur wenig unterhalb der Raumtemperatur erstarren. Die Schmelzenthalpie beträgt 14,37 kJ·mol−1. Bei Normaldruck siedet die Verbindung bei 189 °C. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,49107, B = 1807,002 und C = −60,995 im Temperaturbereich von 325,5 bis 442,1 K. bzw. mit A = 5,23039, B = 2239.161 und C = −29.215 im Temperaturbereich von 293 bis 323 K. Es ist in jedem Verhältnis mit Wasser mischbar, weiterhin mit vielen organischen Lösemitteln wie Alkoholen, Carbonsäureestern, Ketonen, und chlorierten Kohlenwasserstoffen. Es gehört der Gruppe nukleophiler, aprotischer, dipolarer Lösemittel an (wie zum Beispiel Dimethylformamid).
-
 Dampfdruckfunktion
Dampfdruckfunktion -
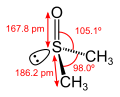 DMSO-Molekül mit Bindungslängen und -winkeln
DMSO-Molekül mit Bindungslängen und -winkeln
Chemische Eigenschaften
Die Verbindung beginnt sich am Normaldrucksiedepunkt bei 189 °C thermisch zu zersetzen, was heftig bis explosionsartig erfolgen kann. Die Zersetzung wird durch Säuren oder Basen katalysiert, so dass diese schon bei wesentlich niedrigeren Temperaturen relevant werden kann. Eine heftige bis explosionsartige Zersetzung erfolgt auch in Gegenwart von Halogenverbindungen, Metallnitraten, Metallperchloraten, Natriumhydrid, Periodsäure und von Fluorierungsmitteln.
Dimethylsulfoxid kann mit Natriumhydrid oder Natriumamid unter Bildung eines Methylsulfinylcarbanions (Dimsylanion) deprotoniert werden, welches als sehr starkes nucleophiles Reagenz in der organischen Synthese verwendet wird. Die Reaktionsgemische können sich oberhalb von 70 °C explosionsartig zersetzen. Es besteht auch beim Isolieren des festen Natriumsalzes Explosionsgefahr.
Sicherheitstechnische Kenngrößen
Dimethylsulfoxid bildet oberhalb des Flammpunktes bei 88 °C entzündbare Dampf-Luft-Gemische. Die untere Explosionsgrenze liegt bei 1,8 Vol.‑% (58 g/m³). Eine obere Explosionsgrenze (OEG) kann wegen der thermischen Zersetzung der Substanz nicht bestimmt werden. Die Sauerstoffgrenzkonzentration wurde bei 200 °C mit 3,9 Vol% bestimmt. Die Zündtemperatur beträgt 270 °C. Der Stoff fällt somit in die Temperaturklasse T3. Die elektrische Leitfähigkeit ist mit 2·10−7 S·m−1 eher gering.
DMSO-d6
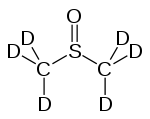
Vollständig deuteriertes DMSO (DMSO-d6) – in dem alle sechs Wasserstoffatome durch Deuterium ausgetauscht sind – wird als Lösungsmittel in der NMR-Spektroskopie benutzt.
Pharmakologie
Dimethylsulfoxid hat entzündungshemmende (antiphlogistische) und schmerzlindernde (analgetische) Eigenschaften. Es findet daher therapeutische Verwendung als perkutanes (lat. durch die Haut) Arzneimittel zur Behandlung lokaler Schmerzzustände (beispielsweise bei Sportverletzungen oder rheumatischen Beschwerden). Da DMSO bei Blutergüssen zum schnellen Abschwellen beiträgt, wird es bei Bedarf besonders in Kampfsportarten angewandt. Eine Studie aus Brasilien konnte zeigen, dass DMSO-Gel und therapeutischer Ultraschall gegenüber anderen Behandlungsformen (bzw. keiner Behandlung) signifikant bessere Ergebnisse im Hinblick auf das Abschwellen stumpfer Verletzungen aufweisen.
Seine besondere Fähigkeit ist das leichte Eindringen in Haut und andere Zellmembranen. Es dient daher als Trägersubstanz bei auf der Haut angewendeten Arzneimitteln (Salben, Gele, Pflaster, Tinkturen) zur Einschleusung der Wirkstoffe wie Heparin oder Analgetika als sogenannter Transportvermittler (auch Penetrationsverstärker, Schleppersubstanzen genannt), d.h., in DMSO gelöste Substanzen werden leicht vom Organismus durch die Haut aufgenommen. Das gilt auch für Gifte, die sonst keine oder schwach wirksame Kontaktgifte darstellen, wie Cyanide. Daher müssen Lösungen von als toxisch geltenden Verbindungen sofort, wenn diese auf die Haut gelangen, mit geeigneten Mitteln (z.B. Wasser) abgespült werden.
Verwendung
DMSO ist ein weitverbreitetes Lösungsmittel in Labor und Technik. So wird es in Spinnlösungen von Polyacrylnitril, als Abbeizmittel, als Lösungsmittel bei der Aromatenextraktion und als Reaktionsmedium bei organischen Synthesen verwendet. Auch viele anorganische Salze haben eine gute Löslichkeit in DMSO.
In der organischen Synthesechemie dient es in der Swern-Oxidation und der Parikh-Doering-Oxidation als Oxidationsmittel. In der Pharmazie dient es als Bestandteil von Salben (siehe Eigenschaften).
In der Zellkultur findet DMSO Verwendung in Einfriermedien bei der Kryokonservierung von eukaryotischen Zellen. Als Gefrierschutzmittel verhindert es während des Einfrierprozesses die Bildung von Eiskristallen; diese können Zellorganellen zerstören und so zum Absterben der Zellen führen. DMSO hemmt die Kristallbildung etwas besser als Glycerin.
Auch die meisten Substanzbibliotheken verwenden DMSO als Lösungsmittel. Da das Lösungsmittel jedoch nicht komplett inert ist, kann dies zu einer Verschlechterung der Probenreinheit führen.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 25.04. 2025