Sulfoxide

Sulfoxide sind eine Klasse chemischer Verbindungen mit organisch gebundenem Schwefel und der allgemeinen Struktur R1-S(=O)-R2, dabei sind R1 und R2 organische Reste. Die Oxidationsstufe des Schwefels liegt zwischen denen in Sulfiden R1-S-R2 und in Sulfonen R1-S(=O)2-R2.
Chiralität
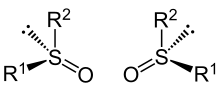
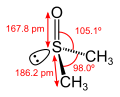
Sulfoxide mit unterschiedlichen Resten R1 und R2 sind chiral, es existieren zwei enantiomere (spiegelbildliche) Formen. Die elektrostatische Abstoßungskraft zwischen dem nichtbindenden Elektronenpaar und den Bindungselektronen führt dazu, dass Sulfoxide nicht planar, sondern pyramidal aufgebaut sind. Daraus ergibt sich deren Chiralität bei ungleichen Substituenten (R1 ≠ R2).


Herstellung
Zur Synthese der Sulfoxide werden die entsprechenden Thioether (Sulfide) oxidiert. Es gibt auch Verfahren zur gezielten Herstellung enantiomerenreiner Sulfoxide.
Vorkommen
Als Inhaltsstoff verschiedener Laucharten (Zwiebeln, Knoblauch) ist das natürliche Sulfoxid Cycloalliin bekannt.
Eigenschaften und Verwendung
Sulfoxide sind schwer flüchtige und polare Verbindungen, ihr einfachster Vertreter ist das als Lösungsmittel benutzte Dimethylsulfoxid. Einige Sulfoxide (Esomeprazol, Omeprazol, Lansoprazol (Takeda), Rabeprazol (Eisai) und Pantoprazol) besitzen als Arzneistoff aus der Gruppe der Protonenpumpenhemmer praktische Bedeutung in der Behandlung von Magen- und Zwölffingerdarmgeschwüren sowie bei Refluxösophagitis.
Dimethylsulfoxid wirkt in der Kornblum-Oxidation als Oxidationsmittel. Dibenzylsulfoxid wird als Bestandteil von Sparbeizen unlegierter und niedrig legierter Stähle verwendet.
Reaktivität
Die Oxidation von Sulfoxiden mit Wasserstoffperoxid oder Kaliumpermanganat liefert Sulfone.
Siehe auch


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 02.06. 2025