Bortrifluorid
| Sicherheitshinweise | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||
| MAK | |||||||||||
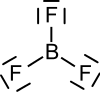
Bortrifluorid ist eine chemische Verbindung, bestehend aus den Elementen Bor und Fluor. Es besitzt die Summenformel BF3 und wird manchmal auch als Trifluorboran bezeichnet.
| Strukturformel | ||
|---|---|---|
| ||
| Allgemeines | ||
| Name | Bortrifluorid | |
| Andere Namen |
| |
| Summenformel | BF3 | |
| Kurzbeschreibung |
farbloses, stechend riechendes, an feuchter Luft rauchendes Gas | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer |
| |
| EG-Nummer | 231-569-5 | |
| ECHA-InfoCard | ||
| PubChem | ||
| Eigenschaften | ||
| Molare Masse | 67,81 g/mol | |
| Aggregatzustand | gasförmig[1] | |
| Dichte | ||
| Schmelzpunkt | −127,1 °C[1] | |
| Siedepunkt | −100,4 °C[1] | |
| Dampfdruck | 28 bar (bei −30 °C)[3] | |
| Löslichkeit | reagiert heftig mit Wasser[1] | |
| Dipolmoment |
0[4] | |
| Brechungsindex | 1,316 (20 °C, Dihydrat)[2] | |
| Thermodynamische Eigenschaften | ||
| ΔHf0 | −1136,0(8) kJ/mol[7] | |
Gewinnung und Darstellung
Bortrifluorid kann gewonnen werden durch:
- Reaktion von Bortrioxid mit Flusssäure:
- im großtechnischen Bereich durch Erhitzen von Dibortrioxid oder Borax mit Calciumfluorid und konzentrierter Schwefelsäure
- im Labor durch Thermolyse von Diazoniumtetrafluoroboraten
- weiter aus Natrium- oder Ammoniumtetrafluoroborat mit Bortrioxid in Schwefelsäure[8]
- oder aus Fluorsulfonsäure und Borsäure:[9]
Eigenschaften
Bortrifluorid bildet eine trigonal-planare Molekülstruktur aus. Es ist eine sehr giftige, bei Raumtemperatur gasförmige chemische Verbindung, die eine kritische Temperatur von −12,3 °C besitzt.
Bortrifluorid ist eine sehr starke Lewis-Säure (Elektronenpaarakzeptor). Es bildet mit Elektronenpaardonatoren Additionsverbindungen (Lewis-Säure-Base-Addukte).
Mit Wasser reagiert es unter Zersetzung zu Borsäure und Flusssäure. Im Gegensatz zu den anderen Bortrihalogeniden findet keine direkte Hydrolyse statt, sondern eine Abfolge mehrerer Reaktionen. Dabei bildet sich aufgrund der starken BF3-Bindung zunächst ein Lewis-Säure-Base-Addukt.
Allerdings ist die Hydrolyse im Gegensatz zu anderen Borhalogeniden nicht vollständig, da sich auch das inerte, tetraedrische Tetrafluoroboration (BF4−) bildet.
Auch die Produkte der Hydrolyse reagieren weiter zur Tetrafluorborsäure, die als Oxoniumsalz vorliegt.
Verwendung
In der chemischen Industrie kann Bortrifluorid für eine Vielzahl von chemischen Reaktionen als Katalysator bzw. als Ausgangsstoff zur Herstellung verschiedener Borverbindungen eingesetzt werden. Gasförmiges Bortrifluorid und Bortrifluorid-Addukte werden hauptsächlich als Katalysatoren oder Co-Katalysatoren benutzt, zum Beispiel bei der Herstellung von Polymeren, hochwertigen Schmierölen, Pharmazeutika, Aroma- und Duftstoffen und weiteren Feinchemikalien sowie zur Synthese von Borverbindungen wie zum Beispiel Alkylboranen, Aminboranen und Reagenzien für die Suzuki-Kupplung. Weiterhin wird es in der Halbleiterindustrie als Borlieferant für die Ionenimplantation (p-Dotierung), zur Oberflächenbehandlung von Stahl und Glas und in Neutronendetektoren verwendet.
Sicherheitshinweise
Bortrifluorid ist sehr giftig und stark ätzend.
Wichtige BF3-Addukte
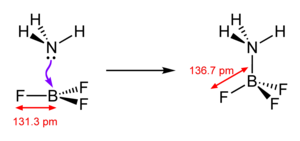
- BF3-Methanol
- BF3-Phenol
- BF3-Dibutylether
- BF3-Diethyletherat
- BF3-Dimethylether
- BF3-THF (Tetrahydrofuran)
- BF3-Essigsäure
- BF3-Acetonitril
- BF3-Dihydrat
- BF3-Phosphorsäure
Einzelnachweise
- ↑ Hochspringen nach: a b c
d e f Datenblatt
 Bortrifluorid
Thermo Fisher Scientific.
Bortrifluorid
Thermo Fisher Scientific.
- ↑ Hochspringen nach: a b Datenblatt
 Boron trifluoride dihydrate, 96% bei
Sigma-Aldrich.
Boron trifluoride dihydrate, 96% bei
Sigma-Aldrich.
- ↑ Hochspringen nach: a b
c Eintrag zu
 Bortrifluorid in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
Bortrifluorid in der
GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung. (JavaScript erforderlich)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Permittivity (Dielectric Constant) of Gases, S. 6-188.
- ↑ Eintrag zu
 Boron trifluoride im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA).
Hersteller bzw. Inverkehrbringer können
die harmonisierte Einstufung und Kennzeichnung
Boron trifluoride im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA).
Hersteller bzw. Inverkehrbringer können
die harmonisierte Einstufung und Kennzeichnung  erweitern.
erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva):
 Grenzwerte – Aktuelle MAK- und
BAT-Werte (Suche nach Bortrifluorid).
Grenzwerte – Aktuelle MAK- und
BAT-Werte (Suche nach Bortrifluorid).
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, CODATA Key Values for Thermodynamics, S. 5-1.
- ↑ H. S. Booth and K. S. Willson: Boron trifluoride. In: Harold Simmons Booth (Hrsg.): Inorganic Syntheses. Band 1. McGraw-Hill, Inc., 1939, S. 21–24 (englisch).
- ↑ Georg Braue (Hrsg.): Handbook of Preparative Inorganic Chemistry. 2nd edition. Band 1. Academic Press, New York NY u. a. 1963, S. 219–221.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 26.07. 2024



