
Thermolyse
Die Thermolyse ist eine chemische Reaktion, bei der ein Ausgangsstoff durch Erhitzen in mehrere Produkte zersetzt wird. Im Gegensatz zur thermischen Zersetzung (= Pyrolyse) wird die Thermolyse gezielt zur Darstellung definierter Produkte oder reaktiver Zwischenstufen eingesetzt.
Bei der Drehrohr-Pyrolyse finden allerdings sehr komplexe Reaktionen statt, die sich je nach Prozesstemperatur stark unterscheiden. Auch hier kommt es zu Neubildung von Verbindungen, sodass die Drehrohr-Pyrolyse unter 1000 °C eigentlich eine Drehrohr-Thermolyse ist.
Beispiele
- Erhitzt man das Salz Ammoniumchlorid, so zersetzt es sich unter Freisetzung der Gase Ammoniak und Chlorwasserstoff.
- NH4Cl (s) → NH3 (g) + HCl (g)
- Quecksilber(II)-oxid, ein roter, kristalliner Feststoff, zerfällt beim Erhitzen in Quecksilber (Bildung silbriger Tröpfchen) und Sauerstoff.
- 2 HgO (s) → 2 Hg (l) + O2 (g)
- Durch Brennen von Kalk (chemisch Calciumcarbonat) wird das Gas Kohlenstoffdioxid freigesetzt. Zurück bleibt der weiße, bröckelige „gebrannte Kalk“ (chemisch Calciumoxid).
- CaCO3 (s) → CaO (s) + CO2 (g)
- Erhitzt man Dicumylperoxid, so wird die Bindung zwischen den beiden Sauerstoffatomen homolytisch gespalten und es entstehen zwei Phenylalkyloxid-Radikale. Diese dienen industriell als Radikalstarter bei der Polymerisation.
- Diacylperoxide – z.B. Dibenzoylperoxid – werden homolytisch unter Bildung zweier Radikale gespalten.
- Beim Erhitzen von Aziden entstehen unter Abspaltung von Stickstoff (N2) Nitrene.
- Beim Erhitzen von Diazoalkanen entstehen unter Abspaltung von Stickstoff (N2) Carbene.
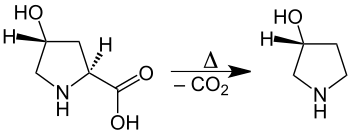
Decarboxylierung
der proteinogenen α-Aminosäure
L-Hydroxyprolin.
- Thermische Decarboxylierung (Abspaltung von Kohlendioxid) von Aminosäuren unter Bildung von Aminen.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 02.10. 2023