Embryophyta
| Landpflanzen | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Vertreter der Embryophyta aus den verschiedenen Abteilungen | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Embryophyta | ||||||||||||
| Engler, 1892[1][2] | ||||||||||||
| Abteilungen | ||||||||||||
|
Die Embryophyta, oft auch als Landpflanzen bezeichnet, sind ein biologisches Taxon, das die Samenpflanzen, die Farne, die Schachtelhalme, die Bärlappgewächse und die Moose umfasst. Das namengebende gemeinsame Merkmal der Embryophyta ist der Embryo, der sich bei Samenpflanzen im Samen befindet. Bislang sind etwa 280.000 Arten beschrieben, darunter etwa 250.000 Bedecktsamer (Blütenpflanzen).[3] Rund ein Fünftel davon sind vom Aussterben bedroht.
Beschreibung

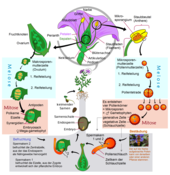
Die Embryophyta zeichnen sich durch einen heterophasischen Generationswechsel aus, bei dem sich eine haploide sexuelle und eine diploide vegetative Generation abwechseln (vgl. Kernphasenwechsel und Diplohaplont). Die beiden Generationen sind unterschiedlich gestaltet (heteromorpher Generationswechsel), wobei bei den Gefäßpflanzen der diploide Sporophyt wesentlich größer ist als der haploide Gametophyt, während es bei den Moosen umgekehrt ist.
Die sexuelle Generation, der Gametophyt, bildet Sexualorgane aus, die als Antheridien (männlich) und Archegonien (weiblich) bezeichnet werden. Bei den Bedecktsamern sind diese auf einzelne Zellen reduziert und nicht mehr als klar umgrenzte Strukturen erkennbar. Die Eizellen verbleiben in den Archegonien und werden hier befruchtet. Bei den Samenpflanzen und insbesondere bei den Bedecktsamern (Blütenpflanzen) sind die Gametophyten extrem reduziert. Der männliche Gametophyt bildet mit einer von der Mutterpflanze ausgebildeten Hülle (Exine) das Pollenkorn und besteht nur aus wenigen Zellen (bei Bedecktsamern nur zwei). Der weibliche Gametophyt wird bei den Samenpflanzen Embryosack genannt und besteht bei den Bedecktsamern zumeist aus sieben Zellen, von denen eine die Eizelle ist.
Der Sporophyt wird nach der Befruchtung zunächst als mehrzelliger Embryo angelegt (daher die Bezeichnung Embryophyta), der an der Mutterpflanze verbleibt und von dieser ernährt wird. Bei den Samenpflanzen ist der reife Same mit dem Embryo ein Ruhestadium und dient der Verbreitung. Schon der Embryo besteht aus den drei Grundorganen Sprossachse, Blatt und Wurzel, die zusammen als Kormus bezeichnet werden. Nur der viel einfacher gebaute Sporophyt der Moose ist nicht derartig differenziert. Die Blätter sitzen seitlich an der Sprossachse, und aus ihren Achseln entspringen Seitentriebe, durch die sich die Sprossachse verzweigt. Dagegen trägt die Wurzel niemals Blätter, und sie verzweigt sich, indem Seitenwurzeln aus ihrem Inneren hervorbrechen.
Die Embryophyta sind wie auch die Algen photoautotroph, d.h. sowohl phototroph als auch autotroph. Dabei bedeutet phototroph, dass sie ihren Energiebedarf aus Licht decken, und autotroph, dass sie organische Stoffe aus anorganischen bilden können und nicht wie die heterotrophen Lebewesen (z.B. Tiere) organische Stoffe als Nahrung aufnehmen müssen. Als Kohlenstoffquelle verwenden sie in der Regel ausschließlich Kohlendioxid. Der Aufbau dieser Stoffe mit Licht als Energiequelle ist die Photosynthese. Heterotrophe Pflanzen sind stets abgeleitete Formen, die im Laufe der Evolution ihr Chlorophyll (Blattgrün) verloren haben. Dabei handelt es sich um verschiedene mykotrophe Pflanzen, die von Pilzen ernährt werden (z.B. einige Orchideen, Corsiaceae, Burmanniaceae), und um Vollschmarotzer auf anderen Pflanzen, z.B. die Rafflesiaceae sowie einige Orobanchaceae und Windengewächse (Cuscuta).
Weitere Merkmale auch der übergeordneten Taxa Charophyta und Chloroplastida sind Chloroplasten mit Chlorophyll a und b als Photosynthesepigmente und Carotinoiden als akzessorische Pigmente, Stärke als Reservepolysaccharid und Zellwände mit Cellulose als Hauptbestandteil. Die Sporenwand bzw. die Exine des Pollenkorns enthält Sporopollenin. Der Sporophyt ist von einer Cuticula umgeben, die als Schutz vor dem Austrocknen durch Verdunstung dient.
Das Wachstum der Sprossachse und der Wurzel erfolgt apikal, d.h. an der Spitze, indem in einem dort befindlichen Meristem (teilungsaktive Zone) Zellteilungen stattfinden und die basal gelegenen Tochterzellen sich anschließend unter erheblicher Volumenzunahme strecken (Streckungswachstum) und auch verdicken (primäres Dickenwachstum). Auch die Blattanlagen gehen aus dem Meristem an der Spitze der Sprossachse (Vegetationskegel) hervor, indem sich an dessen Rand Teile höckerartig abgliedern. Bei der weiteren Entwicklung der Blätter kommt es vielfach auch zu interkalarem Wachstum, indem abseits des randständigen Meristems Zellteilungen und -streckungen auftreten, wodurch z.B. Blattstiele entstehen. Außerdem gibt es bei ausdauernden verholzenden Pflanzen das sekundäre Dickenwachstum, durch das etwa Baumstämme immer dicker werden.
Die höchste derzeit lebende Pflanze ist ein 115 Meter hoher Küstenmammutbaum (Sequoia sempervirens) namens Hyperion in Kalifornien.
Stammesgeschichte

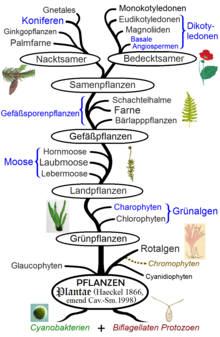
Die stammesgeschichtlich nächsten Verwandten der Embryophyta sind eine Gruppe früher zu den „Grünalgen“ gerechneter Algentaxa, die mit ihnen als Charophyta zusammengefasst werden. Seit einigen Jahren galten die neben den Embryophyta morphologisch komplexesten Charophyta, die Armleuchteralgen, als die nächsten Verwandten, mit denen zusammen sie ein Taxon namens Streptophyta bilden würden. Neuere, vor allem genetische Untersuchungen deuten stattdessen auf die nur einfache Zellfäden bildenden Schmuckalgen als nächste Verwandte hin.[4] Die Charophyta außer den Embryophyta sind Haplonten, d.h. mit Ausnahme der Zygote haploid. Die Embryophyta entwickelten den oben beschriebenen heterophasischen Generationswechsel, wobei anfangs die haploide sexuelle Generation überwog, aber mit der fortschreitenden Emanzipation vom Wasser die diploide vegetative Generation immer stärker in den Vordergrund trat.[5] (Siehe auch: Der Generationswechsel in der Stammesgeschichte der Pflanzen sowie Evolution des Lebenszyklus der Pflanzen.)
Der Übergang von der aquatischen zur terrestrischen Lebensweise (Landgang) wurde offenbar ermöglicht durch eine Symbiose mit Pilzen (Mykorrhiza).[6] Nach einer Studie von 2018 geschah das wahrscheinlich im Kambrium, also vor etwa 500 Millionen Jahren und damit erheblich früher als bislang angenommen.[7]
Die manchmal vertretene Ansicht, es gebe mehrere Abstammungslinien der Embryophyta aus den Algen heraus, wurde bereits durch morphologische Studien als unwahrscheinlich erkannt.[8] Dies wird auch durch molekularbiologische Studien nicht gestützt[9] und daher heute nicht mehr vertreten. Ob die besonderen zellulären Anpassungen der Embryophyta an das Landleben, wie zum Beispiel die besonders stabile Zellwand mit Einlagerung von phenolischen Verbindungen wie Lignin, die besonders ausgefeilten Reaktionswege auf Umweltstress oder der Schutz gegen zerstörerische Einflüsse durch zu starke Belichtung, bereits bei im Süßwasser lebenden, noch einfach gebauten Vorfahren evolvierten (also eine Präadaptation oder Exaptation waren), oder ob sich diese Eigenschaften als Adaptation erst an Land entwickelten, ist wissenschaftlich bis heute umstritten.[4]
Systematik
Äußere Systematik
Die Verwandtschaft der Embryophyta mit den Grünalgen war aufgrund der gemeinsamen Photosynthesepigmente
(Chlorophyll a und b) sowie des Vorkommens von Polysacchariden (echter Stärke) lange
vermutet worden. Molekularbiologisch wurde jedoch eruiert, dass nur ein kleiner Teil der ursprünglich weit gefassten Grünalgen in der Nähe der Embryophyta steht und nur dieser
mit den Embryophyta in die Gruppe der Charophyta gehört. DNA-Sequenzvergleiche zeigten, dass die
makroskopischen Armleuchteralgen, welche bereits morphologische Komplexität etwa durch
ein ihre Eizellen umhüllendes Gewebe bilden, die nächsten lebenden Verwandten der Embryophyta sind. Zusammen bilden sie die Gruppe der
Streptophyta.
| Chloroplastida |
| |||||||||||||||||||||||||||||||||||||||
Innere Systematik
Die rezenten Vertreter der Embryophyta bilden vier deutlich voneinander getrennte Gruppen. Diese sind sowohl nach morphologischen wie auch nach molekularbiologischen Studien monophyletisch: Lebermoose, Laubmoose, Hornmoose und Gefäßpflanzen. Die Stellung dieser vier Gruppen untereinander ist jedoch noch nicht endgültig geklärt. In der Vergangenheit gab es verschiedene Vorschläge, jedoch zeichnet sich folgendes Kladogramm als wahrscheinliche Verwandtschaftsverhältnisse ab:[9]
| Landpflanzen (Embryophyta) |
| ||||||||||||||||||
Die Hornmoose wären demnach die Schwestergruppe der Gefäßpflanzen. Neben molekularbiologischen Studien weisen auch mehrere den Hornmoosen im Vergleich zu den anderen Moosen eigentümliche Merkmale auf die nahe Verwandtschaft zu den Gefäßpflanzen hin: die Sporophyten der Hornmoose sind relativ groß, langlebig und photosynthetisch aktiv, also relativ selbständig. Damit nehmen sie eine Zwischenstellung zwischen den anderen Moosen mit ihren vom Gametophyten abhängigen Sporophyten und den Gefäßpflanzen mit ihren völlig unabhängigen Sporophyten ein.[9] Demnach sind Moose, wie ursprünglich gedacht, keine monophyletische, sondern eine paraphyletische Gruppierung.
Systematik fossiler Vertreter
Bei Einbeziehung fossiler Pflanzen, die an der Basis der Gefäßpflanzen stehen, wird das oben dargestellte Bild etwas komplizierter. Zwar sind fossile Moose aus der Frühzeit der Embryophyta nicht bekannt, dafür sind etliche Vertreter früher Gefäßpflanzen bekannt. Diese wurden im frühen 20. Jahrhundert unter dem Begriff Psilophyten vereinigt, diese Gruppe erwies sich jedoch schon bald als sehr heterogen. Banks hat diese Gruppe in die drei Gruppen Rhyniophyta, Trimerophytophyta und Zosterophyllophyta aufgespalten. Kenrick und Crane[8] zeigten jedoch 1997, dass zumindest die beiden ersten Gruppen künstlich sind. Die Vertreter der beiden letzten Gruppen gehören zu den Eutracheophyten, während die Vertreter der Rhyniophyta sehr basal stehen. Kenrick und Crane stellten folgendes Kladogramm auf:[11]
| Polysporangiophyten |
| ||||||||||||||||||||||||||||||||||||||||||
Zwischen den Moosen (nicht dargestellt) und den Gefäßpflanzen gibt es also noch einige Gruppen ausgestorbener Pflanzen.
Polysporangiophyten
Die Polysporangiophyten umfassen die gesamte oben dargestellte Klade und umfassen alle Embryophyta, die nicht zu einer der Moosgruppen gezählt werden. Ihre gemeinsamen abgeleiteten Merkmale (Synapomorphien) sind: verzweigte Sporophyten mit mehreren Sporangien; der Sporophyt ist unabhängig vom Gametophyten. Die Archegonien sind in den Gametophyten eingesenkt, dies ist aber auch bei den Hornmoosen der Fall.[12]
Zu den Vertretern der Polysporangiophyten gehören als basalste Gruppe die Horneophytopsida mit Horneophyton. Eine isoliert stehende Art ist Aglaophyton major. Die übrigen Vertreter gehören zu den Gefäßpflanzen (Tracheobionta), deren basale Gruppe die Rhyniopsida sind.
Literatur
- Joachim W. Kadereit, Christian Körner, Benedikt Kost, Uwe Sonnewald: Strasburger Lehrbuch der Pflanzenwissenschaften. 37. Auflage. Springer Spektrum, Berlin/Heidelberg 2014.
Einzelnachweise
- ↑ Adolf Engler: Syllabus der Vorlesungen über specielle und
medicinisch-pharmaceutische Botanik. Eine Uebersicht über das ganze Pflanzensystem mit Berücksichtigung der Medicinal- und Nutzpflanzen.
Gebrüder Borntraeger, Berlin 1892, S. 43, 59
(
 online).
online).
- ↑ J. R. Pirani, J. Prado: Embryopsida, a new name for the class of land plants.
In: Taxon. Band 61,
Nr. 5. International Association for Plant Taxonomy, 2012,
S. 1097
(
 researchgate.net [PDF]).
researchgate.net [PDF]).
- ↑ Joachim W. Kadereit, Christian Körner, Benedikt Kost, Uwe Sonnewald: Strasburger Lehrbuch der Pflanzenwissenschaften. 37. Auflage. Springer Spektrum, Berlin/Heidelberg 2014, S. 544–546.
- ↑ Hochspringen nach: a
b Jan de Vries & John M. Archibald (2018): Plant evolution: landmarks on the path to terrestrial life. New Phytologist 217 (4):
1428–1434.
 doi:10.1111/nph.14975
doi:10.1111/nph.14975
- ↑ Lin-Yong Qiu, Alexander B. Taylor, Hilary A. McManus:
 Evolution of the life cycle in land plants.
Journal of Systematics and Evolution 50 (2012), S. 171–194.
Evolution of the life cycle in land plants.
Journal of Systematics and Evolution 50 (2012), S. 171–194.
- ↑ Bin Wang & al.:
 Presence of three mycorrhizal genes in the common ancestor of land plants suggests a key role
of mycorrhizas in the colonization of land by plants. New Phytologist 186, S. 514–525 (2010),
Presence of three mycorrhizal genes in the common ancestor of land plants suggests a key role
of mycorrhizas in the colonization of land by plants. New Phytologist 186, S. 514–525 (2010),
- ↑ Jennifer L. Morris, Mark N. Puttick, James W. Clark, Dianne Edwards,
Paul Kenrick, Silvia Pressel, Charles H. Wellman, Ziheng Yang, Harald Schneider, Philip C. J. Donoghue: The timescale of early
land plant evolution. In: PNAS. 115. Jahrgang,
Nr. 10, Februar 2018,
S. E2274–E2283,
doi:
 10.1073/pnas.1719588115 (englisch).
10.1073/pnas.1719588115 (englisch).
- ↑ Hochspringen nach: a b Paul Kenrick, Peter R. Crane: The Origin and Early Diversification of Land Plants. A Cladistic Study. Smithsonian Institution Press, Washington / London 1997, ISBN 1-56098-729-4, S. 15, 231 (englisch).
- ↑ Hochspringen nach: a b
c Yin-Long Qiu u. a.: The deepest divergences in land plants inferred from phylogenomic evidence. In: Proceedings of the National
Academy of Sciences. 103(42), 2006, S. 15511–15516.
 (online)
(online)
- ↑ Sina M. Adl, A. G. B. Simpson, C. E. Lane, J. Lukeš, D. Bass, S. S. Bowser, M. W. Brown, F. Burki, M. Dunthorn,
V. Hampl, A. Heiss, M. Hoppenrath, E. Lara, L. le Gall, D. H. Lynn, H. McManus, E. A. D. Mitchell, S. E. Mozley-Stanridge, L. W. Parfrey, J. Pawlowski, S. Rueckert, L. Shadwick,
C. L. Schoch, A. Smirnov, F. W. Spiegel: The Revised Classification of Eukaryotes. In: Journal of Eukaryotic Microbiology. 59, 2012, S. 429–514.
 (PDF online)
(PDF online)
- ↑ Paul Kenrick, Peter R. Crane: The Origin and Early Diversification of Land Plants. A Cladistic Study. Smithsonian Institution Press, Washington D.C. 1997, Abb. 4.31.
- ↑ Kenrick, Crane 1997, Tabelle 7.2.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 31.01. 2026