Katalytische Triade
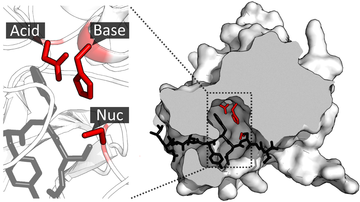
Als katalytische Triade bezeichnet man in der Biochemie eine spezielle Anordnung von drei Aminosäuren im aktiven Zentrum einiger Enzyme. Mit der katalytischen Triade kann in Hydrolasen die Spaltung eines Substrats und in Transferasen der Transfer eines Substratteils auf ein zweites Substrat katalysiert werden. Die drei Aminosäuren fungieren dabei als Säure, Base und Nukleophil und ermöglichen eine kovalente Katalyse.[1][2]
Die Aminosäurereste der katalytischen Triade können in der Aminosäuresequenz (Primärstruktur) weit auseinanderliegen und erst durch die Enzymfaltung, der Ausbildung einer komplexen dreidimensionalen Struktur, in räumliche Nähe gebracht werden.
Aufbau
Aufbau bei Serinproteasen
In Serinproteasen wird die katalytische Triade aus Asparaginsäure, Histidin und Serin gebildet, deren Aminosäurereste über Wasserstoffbrückenbindungen verbunden sind. Der Asparaginsäure-Rest befindet sich in einer für das Lösungsmittel unzugänglichen Tasche und bildet eine Wasserstoffbrücke zu der N-H-Gruppe des Histidinrestes aus. Das so polarisierte Histidin wiederum bildet mit dem zweiten ringgebundenen Stickstoff eine Wasserstoffbrücke zu der OH-Gruppe des Serinrestes aus. Die Wasserstoff-Sauerstoff-Bindung wird hierdurch stark polarisiert und die Nukleophilie des Sauerstoffs weiter erhöht.
Aufbau bei Thiol-/Cysteinproteasen
Bei Cysteinproteasen (auch Thioproteasen genannt) kommen sowohl katalytische Di- als auch Triaden vor. Die katalytische Diade besteht dabei aus Cystein und Histidin, die Triade aus Cystein-Histidin-Asparagin/Asparaginsäure/Glutamin oder Glutaminsäure.
Katalysemechanismus
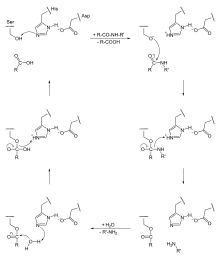
Serinproteinasen katalysieren als Endopeptidasen die hydrolytische Spaltung von Peptidbindungen in Proteinen. Nach Ausbildung des Enzym-Substrat-Komplexes erfolgt ein nukleophiler Angriff des Serin-Sauerstoffs auf den Carbonyl-Kohlenstoff der Peptidbindung unter Ausbildung einer kovalenten Tetraeder-Zwischenstufe (in der sog. Oxyanionlücke). Dabei wird die negative Ladung im Übergangszustand durch Wasserstoffbrücken stabilisiert. Außerdem wird der Wasserstoff aus der Wasserstoffbrücke zum Histidin übertragen. Im zweiten Schritt dient der soeben übertragene Wasserstoff zur Protonierung des Peptid-Stickstoffs, wodurch die Peptidbindung gespalten wird. Der entstandene N-Terminus des gespalteten Proteins diffundiert weg und wird durch Wasser aus dem Lösemittel ersetzt. Eine Wasserstoffbrücke zum Histidin-Rest ermöglicht den nukleophilen Angriff des Wassers am seringebundenen Carbonyl-Kohlenstoff. Nach vollständiger Übertragung des Wasserstoffs zum Histidin erfolgt im letzten Schritt die Ausbildung der ursprünglichen Wasserstoffbrücke zwischen Serin und Histidin, wodurch die kovalente Bindung zum Substrat gespalten wird und der neuentstandene C-Terminus des gespaltenen Proteins abdiffundieren kann. Aufgrund der kovalenten Zwischenstufen gehört der Mechanismus zur Gruppe der kovalenten Katalyse, während der Einfluss des Aspartat-Rests auf das Histidin eine elektrostatische Katalyse darstellt.
Literatur
- D. Voet, J. G. Voet: Biochemie, VCH, 1994, ISBN 3-527-29249-7, S. 368 ff.
Einzelnachweise
- ↑ Guy Dodson, Alexander Wlodawer: Catalytic triads and their relatives. In:
Trends in Biochemical Sciences. Band 23,
Nr. 9, 1. September 1998,
S. 347–352,
doi:
 10.1016/S0968-0004(98)01254-7,
10.1016/S0968-0004(98)01254-7,
 PMID 9787641.
PMID 9787641.
- ↑ Andrew R. Buller, Craig A. Townsend: Intrinsic evolutionary constraints on protease
structure, enzyme acylation, and the identity of the catalytic triad. In: Proceedings of the National Academy of Sciences.
Band 110,
Nr. 8, 19. Februar 2013,
S. E653–661,
doi:
 10.1073/pnas.1221050110,
10.1073/pnas.1221050110,
 PMID 23382230,
PMID 23382230,
 PMC 3581919 (freier Volltext).
PMC 3581919 (freier Volltext).


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 18.05. 2024