
Diederwinkel
Der Dieder- oder
Torsionswinkel beschreibt in der Geometrie
den Winkel zwischen zwei Flächen; dies gilt insbesondere innerhalb einer chemischen
Verbindung für den Winkel zwischen zwei gedachten Flächen. Dabei wird der
Diederwinkel α durch vier Atome und ihre Positionen zueinander definiert; er
entspricht im Beispiel der organischen
Verbindung Ethan
dem Winkel, den die beiden durch
und
aufgespannten Ebenen zueinander einnehmen, wie in nachstehender Abbildung
dargestellt (
und
sind die beiden Kohlenstoffatome,
und
zwei beliebige Wasserstoffatome):
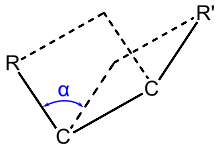
Sind die beiden Kohlenstoffatome
durch eine Einfachbindung
(σ-Bindung) verbunden und nicht in einem cyclischen Molekül arretiert, kann der
Diederwinkel kontinuierlich alle Werte von 0° bis 180° annehmen. Aufgrund von
abstoßenden Wechselwirkungen der Substituenten
und
ist in der Regel ein Winkel von
(trans, s.u.) am günstigsten.
Die Tatsache, dass viele Zucker
unerwarteterweise eine Konformation einnehmen, in der einige Substituenten einen
Diederwinkel von
bevorzugen, wird dem anomeren Effekt zugeschrieben.
Die mit der Drehung um die Bindung variierende Enthalpie des Moleküls kann durch eine spezielle Funktion angenähert berechnet werden:
- mit E: Torsionsenergie; A, B, C: Skalierungsfaktoren; α: Diederwinkel
Die sich aus dieser Funktion ergebende Potentialkurve (angenähert mit Werten
für
und
wie bei n-Butan) sei zur Illustration unten abgebildet.
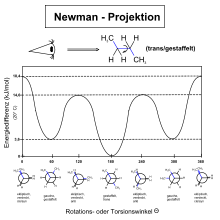
Im Falle des Ethans werden A und B Null, wodurch die Gleichung in das
Pitzer-Potential übergeht. Die Rotationsbarrieren liegen in der Regel bei
wenigen kJ/mol. Dies bedeutet, dass immer ein kleiner Teil (< 20 %)
der Moleküle einen Diederwinkel von
aufweisen. Dabei muss noch berücksichtigt werden, dass die gauche-Formen einen
Entropie-Vorteil von 1,7 kJ/mol haben, da sie in zwei Rotationsisomeren
(+/− synklinal) auftreten. Die für bestimmte Werte des Diederwinkels
entstehenden Konformere
haben eigene Bezeichnungen:
| Winkel | Form | Explizite Beschreibung | Kurzbezeichnung |
|---|---|---|---|
| α = 0° | ekliptisch, verdeckt | syn-periplanar | cis/syn |
| α = 60° | gestaffelt | (+)-synklinal | gauche |
| α = 120° | ekliptisch, verdeckt | (+)-antiklinal | – |
| α = 180° | gestaffelt | antiperiplanar | trans/anti |
| α = 240° | ekliptisch, verdeckt | (−)-antiklinal | – |
| α = 300° | gestaffelt | (−)-synklinal | gauche |
| α = 360° | ekliptisch, verdeckt | syn-periplanar | cis/syn |
Die Formen mit
respektive
sind Enantiomere.
Ist die Rotationsbarriere zu hoch, sind die beiden sich ergebenden Formen nicht
in der Lage, durch Rotation ineinander überzugehen. Sie können dann unter
Umständen einzeln isoliert werden. Dies wird im Fall von speziellen Binaphthylderivaten genutzt, um
außerordentlich selektive Reagenzien zu gewinnen.
Falls zwischen den Kohlenstoffatomen eine Doppelbindung existiert, ist die
Rotation stark eingeschränkt, da hierfür ein Bindungsbruch erfolgen müsste. Es
sind nur zwei Winkel möglich:
(trans/anti) und
(cis). Sind die Substituenten sehr voluminös, kann es in letzterem Fall
aber zu Abweichungen von dem 0°-Winkel kommen.
Zur Bestimmung der Diederwinkel realer Verbindungen stehen verschiedene Methoden zur Verfügung. Dazu gehören die Messung des Dipolmomentes, die Aufnahme von Elektronenbeugungsspektren, die Messung von Kopplungskonstanten mittels NMR oder die Berechnung der optimalen Molekülgeometrie mittels spezieller Computerprogramme.
Torsionswinkel in Proteinen

Die Torsionswinkel des Backbones von Proteinen werden
- ω (zwischen Cα − C' − N − Cα)
- φ (zwischen C' − N − Cα − C')
- ψ (zwischen N − Cα − C' − N) und
genannt. Dadurch kontrolliert der φ-Winkel den Abstand zweier Carbonyl-Kohlenstoffatomen, ψ den Abstand zweier Amid-Stickstoffe und ω den Abstand zweier α-Kohlenstoffe.
Die Planarität der Peptidbindung zwingt den ω-Winkel normalerweise auf 180° (die häufige trans-Konformation) oder 0° (die seltene cis-Konformation). Der Abstand zwischen den α-Kohlenstoffatomen beträgt in der trans- und cis-Konformation etwa 3,8 bzw. 2,8 Å. Die cis-Konformation ist hauptsächlich in der X-Pro-Peptidbindung zu beobachten (X ist eine beliebige Aminosäure), daher gilt Prolin neben dem achiralen Glycin als Strukturbrecher. Die Diederwinkel φ und ψ eines Proteins werden im Ramachandran-Plot dargestellt und sollten zu über 80 % in den Kernbereichen und höchstens vereinzelt in den verbotenen Bereichen der Karte liegen. Bei den besonders günstigen α-Helices z.B. liegt der φ-Winkel etwa bei −60°, der ψ-Winkel etwa bei −30°, wobei beide Winkel eine Toleranz von etwa ±30° zulassen.
Die Torsionswinkel der Seitenketten werden mit χ1 bis χ5 bezeichnet, abhängig vom Abstand zum Backbone. χ1 ist der Torsionswinkel zwischen den Atomen N − Cα − Cβ − Cγ, χ2 zwischen Cα − Cβ − Cγ − Cδ etc.
Die Seitenkettentorsionswinkel scheinen sich um die 180°, 60° und −60° zu häufen. Diese Konformationen werden als anti (oder trans), (+)-gauche und (−)-gauche (oder (+)- bzw. (−)-synklinal) bezeichnet. Welcher Torsionswinkel in einer Seitenkette vorliegt, wird durch Dieder benachbarter Seitenketten und des Backbones bestimmt; so folgt der (+)-gauche-Konformation selten eine weitere (+)-gauche-Konformation (genauso bei (−)-gauche), weil dies die Wahrscheinlichkeit einer Atomkollision erhöht. Die Diederwinkel der Aminosäureseitenketten (χ1 und χ2) können in einem Janin-Plot abgebildet werden.
Siehe auch


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 28.10. 2025