Natriumformiat
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Natriumformiat ist das Natriumsalz der Ameisensäure mit der Konstitutionsformel Na(HCOO).
| Strukturformel | ||
|---|---|---|
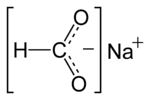 | ||
| Allgemeines | ||
| Name | Natriumformiat | |
| Andere Namen |
| |
| Summenformel | CHNaO2 | |
| Kurzbeschreibung | farblose, zerfließliche, bitter-salzig schmeckende, rhombische Prismen oder Tafeln | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | 141-53-7 | |
| EG-Nummer | 205-488-0 | |
| ECHA-InfoCard | 100.004.990 | |
| PubChem | 2723810 | |
| Eigenschaften | ||
| Molare Masse | 68,01 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 1,92 g/cm3 (20 °C) | |
| Schmelzpunkt | 261 °C (Zersetzung) | |
| Löslichkeit | > 490 g/l (20 °C) in Wasser | |
| Thermodynamische Eigenschaften | ||
| ΔHf0 | −666,5 kJ/mol | |
Darstellung
Technisch wird Natriumformiat aus Natronlauge und Kohlenmonoxid bei 130 °C und 6–8 bar Druck hergestellt:
- Natriumhydroxid reagiert mit Kohlenmonoxid zu Natriumformiat.
Wegen der preisgünstigen großtechnischen Verfügbarkeit von Ameisensäure durch Carbonylierung von Methanol und Hydrolyse des entstehenden Methylformiats wird Natriumformiat meist durch Neutralisation von Ameisensäure mit Natronlauge hergestellt. Natriumformiat entsteht auch als Zwangsanfallprodukt in der letzten Stufe der Pentaerythrit-Synthese, der gekreuzten Cannizzaro-Reaktion von Formaldehyd mit dem Aldol-Reaktionsprodukt Trimethylolacetaldehyd [3-Hydroxy-2,2-bis(hydroxymethyl)-propanal].
Eigenschaften
Physikalische Eigenschaften
Natriumformiat kristallisiert im monoklinen Kristallsystem in der Raumgruppe C2/n (Raumgruppen-Nr. 15, Stellung 5) mit den Gitterparametern a = 6,19 Å, b = 6,72 Å, c = 6,49 Å und β = 121,7°.
Chemische Eigenschaften
Beim Erhitzen zersetzt sich Natriumformiat zunächst unter Bildung von Natriumoxalat und Wasserstoff. Das entstandene Natriumoxalat geht beim weiteren Erhitzen unter Abgabe von Kohlenmonoxid in Natriumcarbonat über.
Als Salz einer schwachen Säure (Ameisensäure) und einer starken Base (Natronlauge) reagiert eine Lösung von Natriumformiat in Wasser basisch:
Eine Lösung von Ameisensäure und Natriumformiat kann also als Pufferlösung eingesetzt werden.
Verwendung

Natriumformiat spielt bei der Synthese von Ameisensäure eine Rolle, hier wird es unter folgender Reaktionsgleichung mit Schwefelsäure zu dieser umgesetzt:
- Das Natriumformiat wird mit Schwefelsäure zu Ameisensäure und Natriumsulfat umgesetzt
Die Brennhaare der Brennnesseln enthalten neben Ameisensäure unter anderem auch Natriumformiat.
Natriumformiat ist schwach wassergefährdend und hemmt einige Bakterienarten, von anderen wird es jedoch abgebaut.
Festes Natriumformiat wird auf Flughäfen zur Enteisung von Start- und Landebahnen, Rollwegen und Vorfeldern, versetzt mit Korrosionsschutzmitteln und anderen Additiven als nichtkorrosives Streumittel eingesetzt, das schnell in feste Schnee- und Eisschichten eindringt, sie vom Asphalt bzw. Beton ablöst und das Eis rasch aufschmilzt („de-icing effect“). Die hohe Gefrierpunktserniedrigung z.B. im Vergleich zum noch häufig eingesetzten, aber wegen seiner eutrophierenden Wirkung problematischen Taumittel Harnstoff verhindert wirksam die Wiedervereisung („anti-icing effect“), auch bei sehr niedrigen Temperaturen unter −15 °C. Die Auftauwirkung des festen Natriumformiats kann durch Befeuchten mit wässrigen Kaliumformiat- oder Kaliumacetat-Lösungen gesteigert werden. Die Abbaubarkeit des Natriumformiats ist mit einem chemischen Sauerstoffbedarf COD von 211 mg O2/g gegenüber den Enteisungsmitteln Natriumacetat mit 740 mg O2/g und Harnstoff mit > 2,000 mg O2/g besonders vorteilhaft.
Gesättigte Natriumformiat-Lösungen werden wie auch Gemische anderer Alkalimetallformiate, z.B. Kalium- und Caesiumformiat, wegen ihrer relativ hohen Dichte als wichtige Bohr- und Stabilisierungshilfsmittel bei der Gas- und Ölexploration eingesetzt. Durch Mischen der entsprechenden gesättigten Alkalimetallformiat-Lösungen können beliebige Dichten zwischen 1,0 und 2,3 g/cm3 eingestellt werden. Die gesättigten Lösungen sind biozid und langzeitstabil gegenüber mikrobiellem Abbau. Verdünnt sind sie wiederum schnell und vollständig bioabbaubar. Da man bei Alkalimetallformiaten als Bohrhilfsmittel auf den Zusatz von festen Füllstoffen, wie z.B. Baryt zur Erhöhung der Dichte verzichten kann und Formiatlösungen an der Bohrstelle wiedergewonnen und recycelt werden können, stellen Formiate einen wichtigen Fortschritt in der Explorationstechnologie dar.
Natriumformiat wird ebenfalls zur Herstellung von Oxalsäure verwendet.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 14.08. 2024