Natriumacetat
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
| Toxikologische Daten | |||||||
Natriumacetat ist ein farbloses, schwach nach Essig riechendes Salz. Es ist das Natriumsalz der Essigsäure und entsteht beispielsweise bei der Reaktion von Natronlauge, Natriumcarbonat oder Natriumhydrogencarbonat mit Essigsäure. Natriumacetat wird richtig als NaOAc abgekürzt. Gelegentlich findet sich dennoch die falsche Abkürzung NaAc (die Abkürzung Ac steht lediglich für eine Acetylgruppe −C(O)CH3). Die Bedeutung der Abkürzung Ac gilt nur im Bereich der organischen Chemie. In der anorganischen Chemie ist Ac das Symbol für das Element Actinium.
Herstellung
Im Labormaßstab kann es z.B. durch Reaktion von Natriumcarbonat (Soda) und Essigsäure gewonnen werden:
Ebenso z.B. durch Neutralisation von Natronlauge mit Essigsäure:
| Strukturformel | |
|---|---|
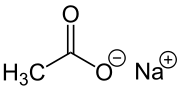 | |
| Allgemeines | |
| Name | Natriumacetat |
| Andere Namen | |
| Summenformel | C2H3NaO2 |
| Kurzbeschreibung | farbloses, kristallines Salz |
| Externe Identifikatoren/Datenbanken | |
| CAS-Nummer |
|
| EG-Nummer | 204-823-8 |
| ECHA-InfoCard | 100.004.386 |
| PubChem | 517045 |
| ChemSpider | 29105 |
| DrugBank | DB09395 |
| Eigenschaften | |
| Molare Masse | 82,03 g/mol
(wasserfrei) 136,08 g/mol (Trihydrat) |
| Aggregatzustand | fest |
| Dichte |
1,52 g/cm3 (20 °C, wasserfrei) 1,42 g/cm3 (20 °C, Trihydrat) |
| Schmelzpunkt |
Zersetzung bei 324 °C 58 °C (Trihydrat) durch Auflösung im eigenen Kristallwasser; Schmelzpunkt Reinsubstanz bei 300 °C |
| Löslichkeit | gut in Wasser (365 g/l bei 20 °C)(Wasserfrei) (613 g/l bei 20°C) (Trihydrat) |
| Thermodynamische Eigenschaften | |
| ΔHf0 | −708,8 kJ/mol |
Eigenschaften

Aus wässrigen Lösungen kristallisiert Natriumacetat mit 3 Mol Kristallwasser: Na(CH3COO) · 3 H2O. Dieses Trihydrat bildet große, farblose Kristalle und ist gut wasserlöslich (612 g/l bei 20 °C) und löst sich ab 58 °C im eigenen Kristallwasser. Bei höherer Temperatur (~120 °C) verdampft das Kristallwasser und es entsteht kristallwasserfreies Natriumacetat Na(CH3COO), abgekürzt als NaOAc. Das wasserfreie Salz ist ebenfalls farblos, brennbar, aber schwer entzündbar, es ist hygroskopisch und gut wasserlöslich (365 g/l bei 20 °C). Wässrige Lösungen von Natriumacetat und Essigsäure bilden eine Pufferlösung, das heißt, der pH-Wert bleibt auch nach Zugabe von (kleineren Mengen) Säure oder Lauge nahezu konstant.
Verwendung


Natriumacetat ist der Lebensmittelzusatzstoff E 262a. Er wird als Säureregulator und Konservierungsmittel für Obst und Gemüse in Dosen und Gläsern, Brot, Fisch in allen Variationen, Feinkostsalaten, Mayonnaisen und Salatsaucen verwendet. Ferner kommt es in Kombination mit verschiedenen Fruchtsäuren (Äpfelsäure, Citronensäure, Weinsäure usw.) in Kartoffelchips der Geschmacksrichtung „Salt & Vinegar“ als Zutat vor.
Auch in Kosmetika wird Natriumacetat zuweilen verwendet, dort neben der Funktion als Puffer auch zur Maskierung des Grundgeruchs.
Aus übersättigter Natriumacetatlösung lassen sich zu Demonstrationsversuchen einfach Kristalle herstellen, die Eisbergen ähneln. Hierfür werden Impfkristalle auf den Boden eines Becherglases gelegt und langsam mit einer übersättigten Natriumacetatlösung begossen. Es bilden sich sofort Kristalle und häufen sich zu einem eisbergähnlichen Turm auf.
Das sogenannte „Instant-Ice“ basiert auf demselben Prinzip. Man füllt ein (durchsichtiges) Gefäß mit der Lösung auf und berührt mit der Fingerspitze die Oberfläche der Lösung. Diese kristallisiert sofort aus und wird fest wie Eis. (Die Fingerspitze ersetzt hier den Impfkristall.)
Die Kristallisation des Natriumacetats ist stark exotherm, so dass hierbei viel Energie in Form von Wärme frei wird. Sie wird in Wärmekissen genutzt, wobei das Trihydrat in regenerierbaren Handwärmern als Latentwärmespeicher dient.
Als Latentwärmespeicher
In umgerüsteten Tankcontainern, die Natriumacetat als Latentwärmespeicher enthalten, können bis zu 2,5 MWh Wärme pro 20-Fuß-ISO-Container (ca. 33 m³) transportiert werden, das entspricht ca. 75 kWh pro m³. So kann beispielsweise die Abwärme von Blockheizkraftwerken nutzbar gemacht werden.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 26.02. 2024