
Lithiumperchlorat
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| ||||||||
Lithiumperchlorat ist das Lithiumsalz der Perchlorsäure und wie viele Perchlorate bei erhöhter Temperatur ein starkes Oxidationsmittel. Es ist ein farbloser, in Wasser, Alkoholen und einigen anderen Lösungsmitteln leicht löslicher Feststoff.
| Strukturformel | |
|---|---|
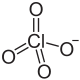 | |
| Allgemeines | |
| Name | Lithiumperchlorat |
| Andere Namen |
Perchlorsaueres Lithium |
| Summenformel | LiClO4 |
| CAS-Nummer |
|
| PubChem | 23665649 |
| ECHA-InfoCard | 100.029.307 |
| Kurzbeschreibung | weißer Feststoff |
| Eigenschaften | |
| Molare Masse | 106,39 g·mol−1 |
| Aggregatzustand | fest |
| Dichte |
|
| Schmelzpunkt | 236 °C |
| Siedepunkt | Zersetzung bei 400 °C |
| Löslichkeit | |
Herstellung
Lithiumperchlorat kann aus Perchlorsäure und Lithiumcarbonat hergestellt werden.
Eigenschaften
Lithiumperchlorat kristallisiert als Trihydrat LiClO4 · 3 H2O im hexagonalen Kristallsystem in der Raumgruppe P63mc (Raumgruppen-Nr. 186). Die Gitterparameter betragen a = 7,719 Å und c = 5,455 Å. Bei 98 - 100 °C geht es unter Wasserabspaltung in ein Monohydrat LiClO4 · H2O über. Das Anhydrat entsteht bei 130 - 150 °C, es ist hygroskopisch und kristallisiert im orthorhombischen Kristallsystem in der Raumgruppe Pnma (Nr. 62) und den Gitterparametern a = 8,657 Å, b = 6,912 Å und c = 4,832 Å. In der Elementarzelle befinden sich vier Formeleinheiten.
Bei 380 °C zersetzt sich reines Lithiumperchlorat zunächst in Lithiumchlorat, Lithiumchlorid und Sauerstoff. Das Lithiumchlorat zersetzt sich ebenfalls:
Die Gesamtreaktion lautet demnach:
Verunreinigtes Lithiumperchlorat kann sich schon unterhalb von 300 °C in heftiger Reaktion zersetzen.
Handhabung
Hitze, offene Flammen, starke Reduktionsmittel und entzündliche Substanzen sollten aufgrund der Explosionsgefahr vermieden werden.
Einsatzbereiche
Lithiumperchlorat wird technisch nur begrenzt eingesetzt, da es teuer und schwer zu handhaben ist. Da es in vielen organischen Lösungsmitteln, einschließlich Ethanol und Ether, relativ gut löslich ist, wird es als Elektrolyt verwendet, wobei insbesondere die Anwendung in Lithiumbatterien bedeutend ist. Ein weiteres Beispiel für eine Verwendung als Elektrolyt in nichtwässrigen Lösungen ist die Herstellung von Polypyrrol, das dann auch mit Lithiumperchlorat dotiert werden kann.
Da Lithiumperchlorat unter allen bisher bekannten Perchloraten das günstigste Masse-Volumen-Verhältnis an Sauerstoff aufweist, wird es in der Luft- und Raumfahrt als Sauerstoffträger geschätzt.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 13.11. 2020

