
Cyanamid
| Sicherheitshinweise | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
| MAK | |||||||||
| Toxikologische Daten | 125 mg/kg (LD50, Ratte, oral)[2] | ||||||||
Cyanamid ist das Amid der Cyansäure. Es kann auch als Nitril der Carbamidsäure und in seiner Gleichgewichtsform Carbodiimid auch als Diimid des Kohlenstoffdioxids aufgefasst werden.
| Strukturformel | ||
|---|---|---|
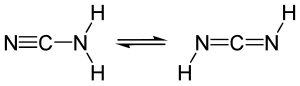
| ||
| Allgemeines | ||
| Name | Cyanamid | |
| Andere Namen |
| |
| Summenformel | CH2N2 | |
| Kurzbeschreibung | farbloser, hygroskopischer Feststoff[1] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | ||
| EG-Nummer | 206-992-3 | |
| ECHA-InfoCard | ||
| PubChem | ||
| ChemSpider | ||
| DrugBank | ||
| Eigenschaften | ||
| Molare Masse | 42,0 g/mol | |
| Aggregatzustand | fest | |
| Dichte | 1,282 g/cm3 (20 °C)[2] | |
| Schmelzpunkt | 44 °C[2] | |
| Siedepunkt | 260 °C (Zersetzung)[2] | |
| Löslichkeit |
| |
| Brechungsindex | 1,4418 (48 °C)[3] | |
| Thermodynamische Eigenschaften | ||
| ΔHf0 | 58,8 kJ/mol[6] | |
Gewinnung und Darstellung
.png)
Cyanamid kann durch Hydrolyse des im Frank-Caro-Verfahren dargestellten Calciumcyanamids (auch Kalkstickstoff) in Gegenwart von Kohlendioxid hergestellt werden:
Lässt man Chlorcyan mit Ammoniak reagieren, dann entsteht ebenfalls Cyanamid, welches mit Carbodiimid im Gleichgewicht steht.
Eigenschaften
Cyanamid ist eine farb- und geruchlose, kristalline, hygroskopische Substanz mit recht hoher Reaktivität, die beim Erhitzen teils explosionsartig polymerisiert. Der giftige Stoff ist brennbar und gut löslich in Wasser (850 g/l bei 25 °C) und organischen Lösungsmitteln. Die als Handelsform blau eingefärbte 50%ige wässrige Lösung reagiert sauer (pH-Wert 3,5–4,2 bei Konzentration von 560 g/l bei 20 °C).[2]
Verwendung
Seit Mitte der 1960er Jahre gibt es Verfahren, Cyanamid zu stabilisieren und im industriellen Maßstab zur Verfügung zu stellen. Wegen der starken Neigung zur Selbstkondensation (Dimer: Dicyandiamid, Trimer: Melamin) in alkalischem Milieu werden Cyanamidlösungen durch Zugabe von 0,5 Gew.% NaH2PO4-Phosphatpuffer stabilisiert. Stabiles festes Cyanamid wird erzeugt durch vorsichtiges Eindampfen einer stabilisierten Cyanamidlösung und anschließende Zugabe eines hydrolyselabilen Ameisensäureester, der Feuchtigkeitsspuren absorbiert (Unterdrückung der Harnstoffbildung), Alkalispuren (Ammoniak) neutralisiert und fortwährend geringe Mengen Ameisensäure freisetzt.[7]
Cyanamid dient in der Landwirtschaft als Dünger und als Pflanzenwachstumsregulator, indem es die Keimruhe bei Obstpflanzen (Tafeltrauben, Kiwis, Äpfeln, Birnen) aufhebt (engl. dormancy breaking agent). Die 50%ige wässrige Lösung wird außerdem als Biozid (Desinfektionsmittel) besonders in der Schweinezucht eingesetzt, da es wirksam Salmonellen und Dysenteriebakterien abtötet und Fliegen in allen Entwicklungsstadien bekämpft.[8]
In der Chemischen Industrie wird Cyanamid als vielfältiger Ausgangsstoff, z. B. zur Herstellung von Herbiziden, Kunstharzen (Härtung von Epoxiden) sowie als Bleichaktivator für Wasserstoffperoxid bei alkalischem pH-Wert in Waschmitteln und zur chlorfreien Zellstoffbleiche benötigt.[9] Der Großteil des Cyanamids wird sofort zu Cyanoguanidin umgesetzt und weiterverarbeitet.[2]
Cyanamid kann als funktionelles Einkohlenstofffragment aufgefasst werden, das als Elektrophil oder Nucleophil reagieren kann. Das Cyanamidanion besitzt den Charakter eines Pseudochalkogenids. Deshalb kann Cyanamid als Analogon zu Wasser oder Schwefelwasserstoff betrachtet werden. Eine zweckmäßige Methode zur Darstellung sekundärer Amine, die nicht mit primären oder tertiären Aminen verunreinigt sind, ist die Umsetzung von Cyanamid mit Alkylhalogeniden zu N,N-Dialkylcyanamiden, die leicht zu Dialkylaminen hydrolysiert und decarboxyliert werden.[10] Cyanamid addiert sich in Gegenwart von N-Bromsuccinimid NBS an olefinische Doppelbindungen. Das Additionsprodukt wird durch Basen in N-Cyanaziridine umgewandelt,[11] in Gegenwart von Säuren zu Imidazolinen cyclisiert, aus denen durch alkalische Spaltung vicinale Diamine dargestellt werden können.[12]
Cyanamid eignet sich auch als vielseitiger Synthesebaustein für Heterocyclen: aus 1,2-Diaminobenzol (o-Phenylendiamin) entsteht 2-Aminobenzimidazol[13], mit dem leicht zugänglichen cyclischen Enamin 4-(1-Cyclohexenyl)morpholin[14] und elementarem Schwefel ein 2-Aminothiazol in guten Ausbeuten.[15] Aus Cyanamid und Chlorcyan ist Natriumdicyanamid in guter Ausbeute und hoher Reinheit zugänglich,[16] das als Zwischenprodukt für Synthesen von pharmazeutischen Wirkstoffen eignet.[17]
Bei der industriellen Synthese des für Muskel-, Nerven- und Hirnfunktion essentiellen Kreatins wird der Guanidinrest durch Reaktion von Cyanamid mit Sarkosin eingeführt.[18]
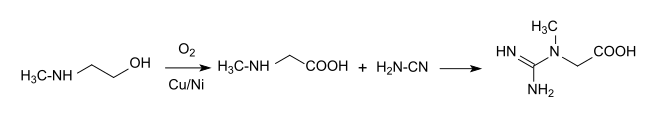
Dieser Syntheseweg vermeidet weitgehend problematische Verunreinigungen mit Chloressigsäure, Iminodiessigsäure oder Dihydrotriazin, die bei anderen Routen auftreten. Analog wird die physiologische Vorstufe Guanidinoessigsäure durch Reaktion von Cyanamid mit Glycin erhalten.[19]
Zulassung
In der EU sind keine Pflanzenschutzmittel mit dem Wirkstoff Cyanamid zugelassen.[20] Dennoch darf Cyanamid in der EU für den Export hergestellt werden.[21] So wird der von der BASF hergestellte Wirkstoff nach wie vor auf dem brasilianischen Markt vertrieben.[22] Auch AlzChem exportiert ein Pestizid mit diesem Wirkstoff in hohen Mengen.[23]
Sicherheitshinweise
Cyanamid ist ein Kontaktgift, das seine Wirkung durch Aufnahme über die Haut entfalten kann. Aufnahme über die Atemwege ist aufgrund des hygroskopischen Charakters und des niedrigen Dampfdrucks der Substanz unwahrscheinlich. Die Resorption über Magen und Verdauungstrakt geschieht schnell, aber unvollständig.[2] Es gibt einzelne Fallberichte über das Auftreten eines Acetaldehydsyndroms nach Hautkontakt mit cyanamidhaltigem Düngemittel und vorangegangenem Alkoholgenuss.[24]
Einzelnachweise
- ↑ Hochspringen nach: a b Eintrag zu Cyanamid. In: Römpp Online. Georg Thieme Verlag.
- ↑ Hochspringen nach: a b
c d e
f g h
i j k Eintrag zu
 Cyanamid in der GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung
Cyanamid in der GESTIS-Stoffdatenbank des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Physical Constants of Organic Compounds, S. 3-124.
- ↑ Eintrag zu
 Cyanamide im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA).
Hersteller bzw. Inverkehrbringer können die harmonisierte
Einstufung und Kennzeichnung
Cyanamide im
Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA).
Hersteller bzw. Inverkehrbringer können die harmonisierte
Einstufung und Kennzeichnung  erweitern.
erweitern.
- ↑ Schweizerische Unfallversicherungsanstalt (Suva):
 Grenzwerte – Aktuelle MAK- und BAT-Werte
(Suche nach 420-04-2 bzw. Cyanamid)
Grenzwerte – Aktuelle MAK- und BAT-Werte
(Suche nach 420-04-2 bzw. Cyanamid)
- ↑ David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-19.
- ↑ Wehrstedt, K.-D.; Wildner, W.; Güthner, T.; Holzrichter, K.; Mertschenk, B.; Ulrich, A.:
Safe transport of cyanamide in J. Hazard. Mat. 170 (2009) 829–835,
doi:
 10.1016/j.jhazmat.2009.05.043.
10.1016/j.jhazmat.2009.05.043.
- ↑ AlzChem:
 ALZOGUR.
ALZOGUR.
- ↑ Patent
 EP0479319B1: Verfahren zur chlorarmen Bleiche und Delignifizierung
von Zellstoff. Angemeldet am 4. Oktober 1991, veröffentlicht am 5. April 1995,
Anmelder: SKW Trostberg AG, Erfinder: Werner Sturm, Ludwig Eibl.
EP0479319B1: Verfahren zur chlorarmen Bleiche und Delignifizierung
von Zellstoff. Angemeldet am 4. Oktober 1991, veröffentlicht am 5. April 1995,
Anmelder: SKW Trostberg AG, Erfinder: Werner Sturm, Ludwig Eibl.
- ↑ Jonczyk, A.; Ochal, Z.; Makosza, M.: Reactions of Organic Anions; LXXXV1. Catalytic Two-Phase Alkylation of
Cyanamide in Synthesis, 1978, 882–883,
doi:
 10.1055/s-1978-24922.
10.1055/s-1978-24922.
- ↑ Ponsold, K.; Ihn, W.: Die Addition von cyanamid und Halogen an Olefine ein neues Verfahren zur Darstellung von
vic.-Halogencyanaminen und Aziridinen in Tetrahedron Lett. 11 (1970) 1125–1128,
doi:
 10.1016/S0040-4039(01)97925-0.
10.1016/S0040-4039(01)97925-0.
- ↑ Harold Kohn, Sang Hun Jung: New stereoselective method for the preparation of vicinal diamines from olefins and
cyanamide. In: Journal of the American Chemical Society. 105, 1983, S. 4106–4108,
doi:
 10.1021/ja00350a068.
10.1021/ja00350a068.
- ↑ Stefan Weiss, Horst Michaud, Horst Prietzel, Helmut Krommer: A New, Simple Synthesis of 2-Aminobenzimidazole.
In: Angewandte Chemie International Edition in English. 12, 1973, S.841,
doi:
 10.1002/anie.197308411.
10.1002/anie.197308411.
- ↑ S. Hünig, E. Lücke, and W. Brenninger:
 1-Morpholino-1-Cyclohexene In:
Organic Syntheses. 41, 1961, S. 65,
doi:
1-Morpholino-1-Cyclohexene In:
Organic Syntheses. 41, 1961, S. 65,
doi: 10.15227/orgsyn.041.0065;
Coll. Vol. 5, 1973, S. 808 (
10.15227/orgsyn.041.0065;
Coll. Vol. 5, 1973, S. 808 ( PDF).
PDF).
- ↑ K. Gewald, H. Spies, R. Mayer: Zur Reaktion von Enaminen mit Schwefel und Cyanamid. In:
Journal für Praktische Chemie. 312, 1970, S. 776,
doi:
 10.1002/prac.19703120507.
10.1002/prac.19703120507.
- ↑ Patent
 EP1154955B1:
Verfahren zur Herstellung von Natrium-Dicyanamid. Angemeldet am 4. Februar 2000, veröffentlicht am
11. September 2002, Anmelder: Süddeutsche Kalkstickstoff, Erfinder: Franz Thalhammer, Helmut Tautz.
EP1154955B1:
Verfahren zur Herstellung von Natrium-Dicyanamid. Angemeldet am 4. Februar 2000, veröffentlicht am
11. September 2002, Anmelder: Süddeutsche Kalkstickstoff, Erfinder: Franz Thalhammer, Helmut Tautz.
- ↑ Lonza:
 Natriumdicyanamid
(Internet Archive)
Natriumdicyanamid
(Internet Archive)
- ↑ Deutsche Offenlegungsschrift DE-OS 10 2006 016 227 A1, Offenlegungsdatum: 11. Oktober 2007, Anmelder: Degussa GmbH.
- ↑ EFSA Panel on Additives and Products or Substances used in Animal Feed (FEEDAP):
Safety and efficacy of guanidinoacetic acid for chickens for fattening, breeder hens and roosters, and pigs. In:
EFSA Journal. Band 14,
Nr. 2, Februar 2016,
doi:
 10.2903/j.efsa.2016.4394.
10.2903/j.efsa.2016.4394.
- ↑ Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu
 Cyanamide (H & Ca cyanamide)
in der EU-Pestiziddatenbank.
Cyanamide (H & Ca cyanamide)
in der EU-Pestiziddatenbank.
- ↑ Maurin Jost:
 Export gesundheitsschädlicher Pestizide: Viel Gift fürs Ausland. In:
taz.de. 29. September 2019,
Export gesundheitsschädlicher Pestizide: Viel Gift fürs Ausland. In:
taz.de. 29. September 2019,
- ↑ Benjamin Luig, Fran Paula de Castro, Alan Tygel, Lena Luig, Simphiwe Dada, Sarah Schneider,
Jan Urhahn:
 Gefährliche Pestizide. (PDF; 2,4 MB) von Bayer und BASF –
ein globales Geschäft mit Doppelstandards. Rosa-Luxemburg-Stiftung, INKOTA-netzwerk, Bischöfliches Hilfswerk Misereor, Campanha Permanente Contra os Agrotóxicos e Pela Vida, Khanyisa,
April 2020,
Gefährliche Pestizide. (PDF; 2,4 MB) von Bayer und BASF –
ein globales Geschäft mit Doppelstandards. Rosa-Luxemburg-Stiftung, INKOTA-netzwerk, Bischöfliches Hilfswerk Misereor, Campanha Permanente Contra os Agrotóxicos e Pela Vida, Khanyisa,
April 2020,
- ↑ Elke Brandstätter, Andreas Maus: Pestizide: Hochgiftige Exporte. In: tagesschau.de. 10. September 2020,
- ↑ L. de Haro: Disulfiram-like syndrome after hydrogen cyanamide professional skin exposure: two case reports in France. In: Journal of agromedicine. Band 14, Nummer 3, 2009, S. 382–384. doi:10.1080/10599240903050704. PMID 19657887.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 09.11. 2025


