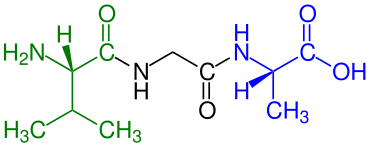Tripeptide
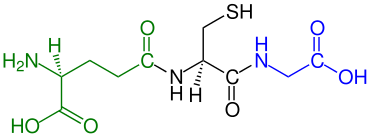
Tripeptide sind aus drei Aminosäure-Resten aufgebaute Peptide und zählen zur Gruppe der Oligopeptide. Wie andere Oligopeptide besitzen Tripeptide häufig eine sehr spezifische physiologische Wirkung, z. B. in der Neurochemie, im Stoffwechsel und als Releasing-Hormone.[2] Proteine werden im Zuge der Verdauung durch Peptidasen in Aminosäuren, Dipeptide und Tripeptide zerlegt.[3] Tripeptide werden im Dünndarm und der Niere über den Peptidtransporter 1 aufgenommen.[4] Tripeptidyl-Peptidasen sind Peptidasen, die Tripeptide abspalten.
Beispiele
Beispiele für natürlich vorkommende Tripeptide sind unter anderem die Antioxidantien Glutathion, die Ophthalminsäure, den Proteaseinhibitor Leupeptin, das Melanotropin-Release-Inhibiting-Hormon, die Lactotripeptide, GHK-Cu und das Herbizid Bialaphos. Einige natürliche Tripeptide besitzen ein Amid am C-Terminus, wie Thyreoliberin und das Melanotropin-Release-Inhibiting-Hormon. Die Peptidalkaloide unter den Mutterkornalkaloiden enthalten unter anderem ein Tripeptid. Ein nichtribosomal erzeugtes Peptid ist das ACV-Tripeptid. Synthetische Tripeptide sind die ACE-Hemmer Lisinopril, Enalapril und Ramipril sowie neuroprotektive Analoga des Thyreoliberins.[5]
Natürliche Tripeptide aus Milch (Casein) werden intakt resorbiert und wirken u.a. als schwache ACE-Hemmer.[6][7] Eine Wirkung an Opioidrezeptoren wird für Beta-Casomorphin beschrieben.[8]
Literatur
- S. Santos, I. Torcato, M. A. Castanho: Biomedical applications of dipeptides and tripeptides. In:
Biopolymers. Band 98,
Nr. 4, 2012,
S. 288–293,
 PMID 23193593 (englisch).
PMID 23193593 (englisch).
Siehe auch
Einzelnachweise
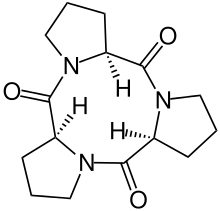
- ↑ M. Rothe, K.-D. Steffen, I. Rothe: Synthese von Cyclo-tri-L-prolyl, einem Cyclo-tri-peptid mit neungliedrigem Ring, Angewandte Chemie 77, 1965, S. 347–348.
- ↑ Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 6: T–Z. 8. neubearbeitete und erweiterte Auflage. Franckh’sche Verlagshandlung, Stuttgart 1988, ISBN 3-440-04516-1, S. 4360.
- ↑ G. Wu: Dietary protein intake and human health. In: Food & function. Band 7, Nummer 3, März
2016, S. 1251–1265, doi:
 10.1039/c5fo01530h,
10.1039/c5fo01530h,
 PMID 26797090.
PMID 26797090.
- ↑ T. Terada, K. Inui: Recent advances in structural biology of peptide transporters. In:
Current topics in membranes. Band 70, 2012, S. 257–274, doi:
 10.1016/B978-0-12-394316-3.00008-9,
10.1016/B978-0-12-394316-3.00008-9,
 PMID 23177989.
PMID 23177989.
- ↑ A. I. Faden, S. M. Knoblach, V. A. Movsesyan, P. M. Lea, I. Cernak: Novel neuroprotective tripeptides and
dipeptides. In: Annals of the New York Academy of Sciences. Band 1053, August 2005, S. 472–481,
doi:
 10.1196/annals.1344.041,
10.1196/annals.1344.041,
 PMID 16179555.
PMID 16179555.
- ↑
 Studie
bioaktive Peptide in Milch und Milchprodukten Enährungswissenschaft. (PDF).
Studie
bioaktive Peptide in Milch und Milchprodukten Enährungswissenschaft. (PDF).
- ↑ Nussberger: Blutdrucksenkende Tripeptide aus der Milch. In:
Therapeutische Umschau.
Band 64,
Nr. 3, 1. März 2007,
ISSN 0040-5930, S. 177–179,
doi:
 10.1024/0040-5930.64.3.177.
10.1024/0040-5930.64.3.177.
- ↑ Keith Bernard Woodford: Casomorphins and Gliadorphins Have Diverse Systemic
Effects Spanning Gut, Brain and Internal Organs. In: International Journal of Environmental Research and Public Health.
Band 18,
Nr. 15, Januar 2021,
ISSN 1660-4601, S. 7911,
doi:
 10.3390/ijerph18157911,
10.3390/ijerph18157911,
 PMID 34360205,
PMID 34360205,
 PMC 8345738 (freier Volltext).
PMC 8345738 (freier Volltext).


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 21.11. 2025